
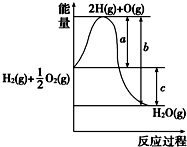
分析 (1)实验有两个过程:配制准确浓度的草酸溶液,所需要的实验仪器主要有天平(含砝码)、烧杯、药匙、100mL容量瓶、胶头滴管、玻璃棒等;
用高锰酸钾溶液进行滴定测草酸的物质的量:所需要的实验仪器主要有烧杯、酸式滴定管、铁架台(带滴定管夹)、锥形瓶等;根据以上操作中使用的仪器进行解答;
(2)KMnO4溶液具有强氧化性,能够腐蚀橡皮管,故KMnO4溶液应装在酸式滴定管中;
(3)根据实验操作对c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$的影响分析误差;
(4)根据化学方程式中各物质的关系进行计算出草酸的浓度,从而计算出样品中含有草酸的质量、结晶水的质量,最后计算出草酸晶体中x值.
解答 解:(1)为了准确配制一定浓度浓度的草酸溶液,所需要的实验仪器主要为:天平(含砝码)、烧杯、药匙、100mL容量瓶、胶头滴管、玻璃棒等;
用高锰酸钾溶液进行滴定测草酸的物质的量,所需要的实验仪器主要有:烧杯、酸式滴定管、铁架台(带滴定管夹)、锥形瓶等,
则在以上操作中不需要的仪器有:f.漏斗、j.烧瓶;还缺少的仪器为:胶头滴管,
故答案为:fj;胶头滴管;
(2)KMnO4溶液具有强氧化性,可以腐蚀碱式滴定管中的橡皮管,故KMnO4溶液应装在酸式滴定管中,
故答案为:酸;KMnO4溶液有强氧化性,能腐蚀碱式滴定管中的橡皮管;
(3)在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,蒸馏水不影待测液的物质的量,对V(标准)无影响,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$可知,c(待测)不变,则对所测得的x值无影响,
故答案为:无影响;
(4)2KMnO4 ~5H2C2O4
2 5
aV×10-3mol 0.025×cmol
c=$\frac{5aV×10{\;}^{-3}mol}{2×0.025mol}$=0.1aVmol•L-1,
样品中含有草酸的质量为:90g/mol×0.1aVmol/L×0.025L×4=0.9aVg,Wg草酸晶体中含有结晶水的质量为Wg-0.9aVg,
草酸晶体中含有结晶水数目为:x=$\frac{\frac{Wg-0.9aVg}{18g/mol}}{\frac{0.9aVg}{90g/mol}}$=$\frac{50W}{9aV}$-5,
故答案为:0.1aV;$\frac{50W}{9aV}$-5.
点评 本题考查一定物质的量浓度溶液配制、滴定操作中仪器的选用及滴定误差分析,题目难度中等,注意掌握配制一定物质的量浓度的溶液即中和滴定操作的方法,能够根据操作步骤选用仪器、根据操作方法判断滴定误差.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 在pH=12的溶液中,K+、Cl-、AlO2-、NH4+可以大量共存 | |
| B. | 由0.1 mol•L-1一元酸HA溶液的pH=3,可推知NaA溶液存在A-+H2O?HA+OH- | |
| C. | 由0.1 mol•L-1一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH=B++OH- | |
| D. | 在pH=0的溶液中,Na+、NO3-、SO32-、K+可以大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2是酸性氧化物,能与NaOH溶液反应 | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | |
| C. | CO、CO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氯可以装入钢瓶中贮存 | |
| B. | 氯水可漂洗衣服上的墨渍 | |
| C. | 实验室使用的氯水要装在棕色瓶中,并且随配随用 | |
| D. | 实验室可利用强氧化剂如KMnO4、KClO3等与浓HCl反应的原理制Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
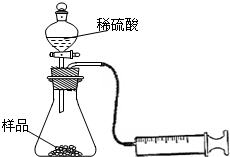 某学校化学科研小组从文献资料上获得如下信息:NaHCO3在潮湿的空气中会缓慢分解成Na2CO3、H2O和CO2.为了验证这一信息,该科研小组将一瓶在潮湿空气中久置的NaHCO3样品混合均匀后,进行如下实验:
某学校化学科研小组从文献资料上获得如下信息:NaHCO3在潮湿的空气中会缓慢分解成Na2CO3、H2O和CO2.为了验证这一信息,该科研小组将一瓶在潮湿空气中久置的NaHCO3样品混合均匀后,进行如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
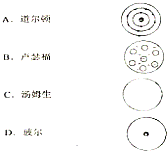 (1)将下列科学家与他们的原子结构模型(如图)用线连接起来:
(1)将下列科学家与他们的原子结构模型(如图)用线连接起来:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•Lˉ1BaCl2溶液 | B. | 澄清石灰水 | ||
| C. | 稀盐酸 | D. | pH试纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用饱和Na2CO3溶液除去混在CO2中的HCl气体 | |
| B. | 用Cl2除去Fe2(SO4)3溶液中的少量FeSO4 | |
| C. | 用加热的方法除去混在碳酸钠固体中的碳酸氢钠杂质 | |
| D. | 向AlCl3溶液中加入过量的NaOH溶液以制备Al(OH)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com