
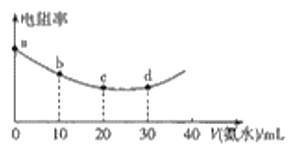
【题目】298K时用0.05mol·L-1氨水滴定20mL0.05mol·L-1的叠氮酸(HN3)溶液,滴定过程中混合溶液的电阻率变化情况如图所示,已知NH3·H2O的电离常数Kb=1.7×10-5,HN3的电离常数Ka=1.9×10-5.下列说法中错误的是
A.电阻率与离子浓度和离子所带电荷有关
B.a、b、c、d四点中,水的电离程度最大的是c
C.c~d之间可能存在:c(N3-)=c(NH4+)>c(H+)=c(OH-)
D.若用0.05mol·L-1HN3溶液滴定20mL0.05mol·L-1氨水,则所得曲线完全相同
【答案】D
【解析】
A.溶液的导电性与离子浓度和离子所带的电荷有关,溶液的导电性越强,其电阻率越小,故电阻率与离子浓度和离子所带电荷有关,A正确;
B.c点是氨水和叠氮酸恰好完全反应,故此时溶液就是叠氮酸铵,溶液中只有离子的水解,没有氨水或叠氮酸的电离,故对水的电离其促进作用,故a、b、c、d四点中,水的电离程度最大的是c,B正确;
C.c点是氨水和叠氮酸恰好完全反应的时刻,由于NH3·H2O的电离常数Kb=1.7×10-5,HN3的电离常数Ka=1.9×10-5,故![]() 的水解程度大于
的水解程度大于![]() 的水解程度,故此时溶液呈弱酸性,继续氨水溶液可能呈中性,故c~d之间可能存在:c(N3-)=c(
的水解程度,故此时溶液呈弱酸性,继续氨水溶液可能呈中性,故c~d之间可能存在:c(N3-)=c(![]() )>c(H+)=c(OH-),C正确;
)>c(H+)=c(OH-),C正确;
D.NH3·H2O的电离常数Kb=1.7×10-5,HN3的电离常数Ka=1.9×10-5,二者电离平衡常数略有差别,加上离子的移动速率也是影响电阻率一个因素,故若用0.05mol·L-1HN3溶液滴定20mL0.05mol·L-1氨水所得曲线不完全相同,D错误;
故答案为:D。


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
【题目】如图是从小白菊中提取的一种有机物。下列关于该有机物的说法正确的是
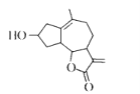
A.可在酸件或碱性溶液中稳定存在
B.其同分异构体存在芳香族化合物
C.能使溴水或酸性KMnO4溶液褪色,其原理相同
D.分子中所有原子一定在同一平面内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有等体积的硫酸、盐酸和醋酸三种溶液,将它们分别与V1L、V2L、V3L等浓度的NaOH溶液混合,下列说法中正确的是( )
A.若混合前三溶液物质的量浓度相等,混合后溶液呈中性,则V1<V2<V3
B.若混合前三溶液pH相等,酸碱恰好完全反应,则V1=V2>V3
C.若混合前三溶液物质的量浓度相等,酸碱恰好完全反应,则V1>V2>V3
D.若混合前三溶液pH相等,将它们同等倍数稀释后再与足量锌片反应,则醋酸溶液放出气体最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜制印刷电路板蚀刻液的选择及再生回收是研究热点。
(1)用HCl-FeCl3溶液作蚀刻液
①该溶液蚀刻铜板时发生主要反应的离子方程式为__________.
②从废液中可回收铜井使蚀刻液再生。再生所用的试剂有Fe和______(填化学式)。
(2)用HCl-CuCl2溶液作蚀刻液蚀刻铜后的废液中含Cu+ 用下图所示方法可使蚀刻液再生并回收金属铜。
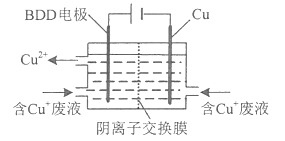
第一步BDD电极上生成强氧化性的氢氧自由基(HO·):H2O-e-==HO·+H+: .
第二步HO·氧化Cu+实现CuCl蚀刻液再生:________(填离子方程式) .
(3)用碱性CuCl2溶液(用NH3·H2O-NH4Cl调节pH)作蚀刻液
原理为:CuCl2+ 4NH3·H2O==Cu(NH3)4Cl2+ 4H2O;Cu(NH3)4Cl2+Cu== 2Cu(NH3)2Cl
①过程中只须及时补充NH3·H2O和NH4Cl就可以使蚀刻液再生,保持蚀刻能力。蚀刻液再生过程中作氧化剂的是_________(填化学式) 。
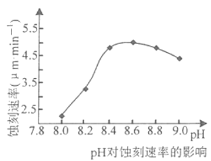
②50℃,c(CuCl2)=2.5mol·L-1, pH对蚀刻速串的影响如图所示。适宜pH约为8.3~9.0,pH过小或过大,蚀刻速率均会减小的原因是______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院上海有机化学研究所有机氟化学重点实验室在寻找新的![]() 反应砌块的过程中,意外发现一种安全、高效合成罕见的硫(Ⅵ)氟类无机化合物
反应砌块的过程中,意外发现一种安全、高效合成罕见的硫(Ⅵ)氟类无机化合物![]() (氟磺酰基叠氮)的方法,该化合物对于一级胺类化合物有极高的重氮转移反应活性和选择性.请回答下列问题:
(氟磺酰基叠氮)的方法,该化合物对于一级胺类化合物有极高的重氮转移反应活性和选择性.请回答下列问题:
(1)基态硫的价电子排布为_________________,氟的最高能级中电子云的形状为_______________.
(2)![]() 中四种元素的第一电离能由大到小的顺序为___________________.
中四种元素的第一电离能由大到小的顺序为___________________.
(3)以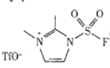 和NaN3为原料在一定条件下可合成
和NaN3为原料在一定条件下可合成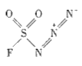 (氟磺酰基叠氮).
(氟磺酰基叠氮).
①NaN3中阴离子的中心氮原子的杂化方式为__________________.
② 中不存在_______________(填字母).
中不存在_______________(填字母).
A.极性键B.非极性键C.离子键D.金属键E.σ键F.π键
(4)H-S-C≡N和H-N=C=S均为叠氮酸(HN3)的等电子体,二者的沸点: H-S-C≡N<H-N=C=S,其原因是_________________,H-S-C≡N、H-N=C=S晶体中,有一种采用分子密堆积,即配位数为12,该物质是_____________________(填结构式).
(5)NaN3晶体的晶胞结构如图所示.
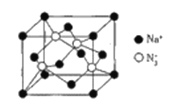
①晶体中,每个Na+周围与它距离最近且相等的Na+共有_____________个
②设阿伏加德罗常数的值为NA,晶胞参数为apm,则NaN3晶体的密度为_____________g·cm-3(列出计算式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用 R代表)。 回答下列问题:
(1)基态氮原子价层电子的轨道表示式为_____。
(2)氯离子的基态电子排布式为_____,有_____种不同能级的电子。
(3)R 中 H、N、O 三种元素的电负性由大到小的顺序是_____(用元素符号表示)。
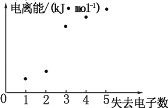
(4)如图表示短周期元素 X 的基态原子失去电子数与对应电离能的关系,试推测 X 与R 中的_____(填元素符号)元素同周期。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)生产铁基颜料铁黄(FeOOH)的制备流程如下:
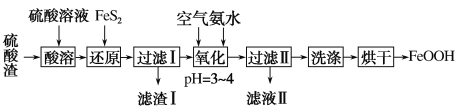
(1)“酸溶”时,Fe2O3与硫酸反应的离子方程式为___________________。
(2)滤渣I的主要成分是FeS2、S和___________(填化学式);Fe3+被FeS2还原的离子方程式为_______________。
(3)“氧化”中,生成FeOOH的离子方程式为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com