
【题目】某一重要烃的衍生物,其结构简式如图所示,下列说法中正确的是
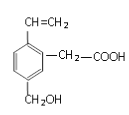
A. 该物质的分子式为C11H13O3
B. 该物质可以使酸性高锰酸钾溶液褪色,证明其含有碳碳双键
C. 1mol该有机物,一定条件下最多可以和5molH2加成
D. 1mol该有机物,与Na和NaHCO3反应产生的气体在相同条件下体积比为1 :1
科目:高中化学 来源: 题型:
【题目】2015年进入冬季以来,我国许多城市出现雾霾天气,下列做法能减轻雾霾形成的是
A.市郊露天焚烧秸秆 B.推广使用燃煤发电
C.大量使用机动车辆 D.多利用太阳能发电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用含少量硫酸铁的硫酸钠固体,制取芒硝(Na2SO4·10H2O),操作流程图如下所示,请回答下列问题:
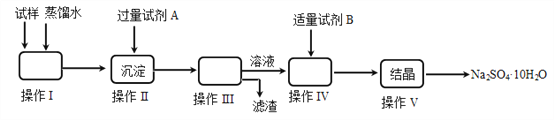
(1)操作I的名称是________;操作III所需的玻璃仪器有________________________。
(2)试剂A为__________;试剂B为__________,加入试剂B的目的是__________________,实验中加入适量试剂B的实验方案为___________________。
(3)操作V的步骤依次是________(用编号填入)
a.过滤 b.冷却 c.蒸发浓缩 d.蒸发至接近蒸干
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:酯能在碱性条件下发生如下反应:RCOOR′+NaOH―→RCOONa+R′OH,醛在一定条件下能被氧化成羧酸。某种烃的含氧衍生物A,其相对分子质量为88,分子内C、H、O 的原子个数之比为2∶4∶1,A与其它物质之间的转化关系如下:
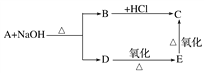
请回答下列问题:
(1)写出 A、E 的结构简式:
A___________________,E_________________。
(2)写出 C 与 D 在一定条件下发生反应的化学方程式: ____________________。
(3)A的同分异构体中属于羧酸的有________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K、Ka、KW分别表示化学平衡常数、电离常数和水的离子积常数,下列判断正确的是( )
A. 在500℃、20 MPa条件下,在5 L密闭容器中进行合成氨的反应,使用催化剂后K增大
B. 室温下Ka(HCN) < Ka(CH3COOH),说明CH3COOH电离产生的c(H+)一定比HCN电离产生的c(H+)大
C. 25℃时,pH均为4的盐酸和NH4I溶液中KW不相等
D. 2SO2+O2![]() 2SO3达平衡后,改变某一条件时K不变,SO2的转化率可能增大、减小或不变
2SO3达平衡后,改变某一条件时K不变,SO2的转化率可能增大、减小或不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质性质与应用对应关系不正确的是
A. 乙烯可以发生加成反应,常用作制取溴乙烷
B. 三硝基甲苯(TNT)难溶于水,可用作烈性炸药
C. 丙三醇具有很强的吸湿性,可用作配制化妆品
D. 乙炔可燃(氧炔焰温度可达3000℃以上),氧炔焰常用作焊接金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应3Cl2 + 6NaOH=5NaCl + NaClO3 + 3H2O,对该反应的下列说法不正确的( )
A. Cl2既是氧化剂,又是还原剂
B. 反应中转移的电子数为5e-
C. 氧化剂与还原剂的质量比是1∶5
D. 被氧化的氯原子数与被还原的氯原子数之比是1∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蜜蜂信息素的成分之一是乙酸异戊酯,它具有香蕉的香味,实验室用乙酸和异戊醇[(CH3)2CHCH2CH2OH]制备乙酸异戊酯的反应、装置示意图和有关数据如下:
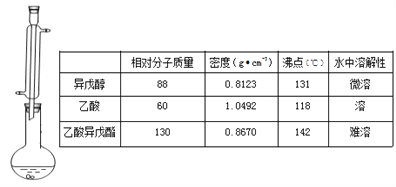
实验步骤:
在A中加入4.4 g的异戊醇,6.0 g的乙酸、数滴浓硫酸和23片碎瓷片,开始缓慢加热A,回流50min,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物中加入少量无水MgSO4固体,静置片刻,过滤除去MgS04固体,进行蒸馏纯化,收集140143℃馏分,得乙酸异戊酯3.9g.
回答下列问题:
(1)装置B的名称是 ___________,作用是______________。
(2)碎瓷片的作用是______________ 。
(3)欲得到乙酸异戊酯,在洗涤、分液操作中,应充分振荡,然后静置,待分层后__________
a.直接将乙酸异戊酯从分液漏斗上口倒出
b.直接将从分液漏斗下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)实验中加入少量无水MgS04的目的是____________ 。
(5)A中的反应方程式为___________________,本实验的产率是____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜,锌元素的化合物种类很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)CuSO4和Cu(NO3)2是自然界中重要的铜盐。
① CuSO4和Cu(NO3)2中阳离子的基态价层电子排布式为_______________。
② S、O、N三种元素的第一电离能由大到小为_____________。
③ CuSO4的熔点为560℃,Cu(NO3)2的熔点为115℃,CuSO4熔点更高的原因是________。
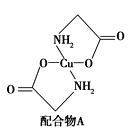
(2)硫酸铜溶液中滴入氨基乙酸钠(H2NCH2COONa)即可得到配合物A,其结构如图所示。请回答下列问题:
① 配合物A中N原子的轨道杂化类型为__________。
② 1 mol配合物A含有σ键的数目为_____________。
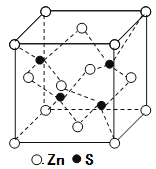
(3)立方ZnS晶体的密度为ρg·cm-3, 其晶胞结构如图。S2-周围等距离且最近的Zn2+、S2-依次为______、______;ZnS晶胞中的晶胞参数a=________nm(列出计算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com