
【题目】利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯,进行水体修复的过程如图所示。H+、O2、![]() 等共存物的存在会影响水体修复效果,定义单位时间内ZVI释放电子的物质的量为nt,其中用于有效腐蚀的电子的物质的量ne。下列说法错误的是
等共存物的存在会影响水体修复效果,定义单位时间内ZVI释放电子的物质的量为nt,其中用于有效腐蚀的电子的物质的量ne。下列说法错误的是
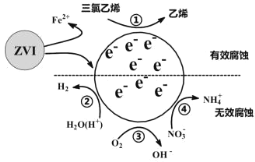
A.反应①②③④均在正极发生
B.④的电极反应式为![]() +10H++8e-=
+10H++8e-=![]() +3H2O
+3H2O
C.单位时间内,三氯乙烯脱去amolCl时ne=amol
D.增大单位体积水体中小微粒ZVI的投入量,可使nt增大
【答案】C
【解析】
A.由修复过程示意图中反应前后元素化合价变化可知,反应①②③④均为得电子的反应,所以应在正极发生,A项正确;
B.由示意图及元素N的化合价变化可写出如下转化NO3-+8e-→NH4+,由于生成物中有NH4+,所以只能用H+和H2O来配平该反应而不能用H2O和OH-来配平,所以④的电极反应式为![]() +10H++8e-=
+10H++8e-=![]() +3H2O,B项正确;
+3H2O,B项正确;
C.三氯乙烯C2HCl3中C原子化合价为+1价,乙烯中C原子化合价为-2价,1 mol C2HCl3转化为1 mol C2H4时,得到6 mol电子,脱去3 mol氯原子,所以脱去a mol Cl时ne=2a mol,C项错误;
D.增大单位体积水体中小微粒ZVI的投入量,可以增大小微粒ZVI和正极的接触面积,加快ZVI释放电子的速率,可使nt增大,D项正确;
故选C。


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
【题目】若含有1 mol铁离子和1 mol铝离子的混合溶液,现按下图横坐标依次加入8 mol 氢氧化钠溶液、1 mol盐酸,通入1 mol 二氧化碳气体,纵坐标为混合沉淀的物质的量。

(1)请画出沉淀的量随反应的变化曲线______________。
(2)并写出加入氢氧化钠6 mol及其后发生的各步反应的离子方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列应用与水解原理无关的是
A. 实验室盛放碳酸钠溶液的试剂瓶不能用玻璃塞
B. 泡沫灭火器用碳酸氢钠溶液和硫酸铝溶液,使用时只需将两者混合就可产生大量二氧化碳的泡沫
C. 浓硫化钠溶液有臭味
D. 可用碳酸钠与醋酸制取少量二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
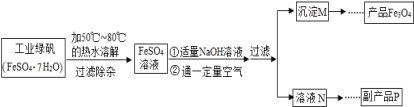
【题目】同学们对四氧化三铁产生了兴趣,从参考资料中找到氧化沉淀法生产复印用高档四氧化三铁粉的工艺流程简图。
[生产流程]
[查阅资料]
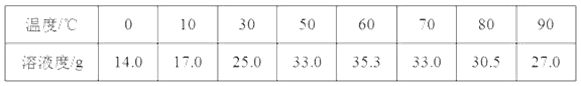
资料一:硫酸亚铁在不同温度下的溶解度如下表所示:
资料二:氢氧化亚铁受氧气氧化反应原理为4Fe(OH)2+2H2O+O2=4Fe(OH)3
资料三:获得四氧化三铁的反应原理为Fe(OH)2+2Fe(OH)3![]() Fe3O4+4H2O
Fe3O4+4H2O
[问题讨论]
(1)溶解时,用50℃至80℃的热水目的是______________。
(2)写出加入适量氢氧化钠溶液时发生反应的化学方程式_____________。
(3)上述过程中,要控制“通一定量空气”的目的是____________。
(4)要使四氧化三铁的产率最高,则上述流程中产生的氢氧化亚铁和氢氧化铁的最佳质量比为___。
(5)副产品P是硫酸钠,由溶液N获得该副产品的操作顺序是b→______→______→d。
a.过滤b.加热浓缩c.冷却结晶d.晶体加热至完全失去结晶水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙两个装置的烧杯中分别盛有足量的CuCl2溶液。
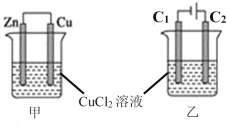
(1)甲装置中,Zn电极发生______反应(填“氧化”或“还原”),溶液中Cl-向_____极(填“Zn”或“Cu”)移动,Zn电极反应式为_______,若反应过程中有0.1mol电子发生转移,则Cu极质量增加__________。
(2)乙装置中,石墨电极C1是_______极,现象是______,C2极电极反应式为_______,若反应过程中阴极析出12.8g的Cu,则阳极产生的气体在标准状况下的体积为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)是具有紫色光泽的粉末,是一种高效绿色强氧化剂,碱性条件下稳定,可用于废水和生活用水的处理。实验室以石墨和铁钉为电极,以不同浓度的NaOH溶液为电解质溶液,控制一定电压电解制备高铁酸钠,电解装置和现象如下:
c(NaOH) | 阴极现象 | 阳极现象 |
1 mol·L-1 | 产生无色气体 | 产生无色气体,10min内溶液颜色无明显变化 |
10 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,3min后溶液变为浅紫红色,随后逐渐加深 |
15 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,1min后溶液变为浅紫红色,随后逐渐加深 |
下列说法不正确的是

A. a为铁钉,b为石墨
B. 阴极主要发生反应:2H2O + 2e-=== H2↑+ 2OH-
C. 高浓度的NaOH溶液,有利于发生Fe-6e-+ 8OH-=== FeO42-+ 4H2O
D. 制备Na2FeO4时,若用饱和NaCl溶液,可有效避免阳极产生气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中两个变化所发生的反应,属于同一类型的是
A.由苯制硝基苯、由乙醇制取乙酸乙酯
B.乙烯使溴的CCl4溶液褪色、甲苯使酸性高锰酸钾水溶液褪色
C.由HO-CH2-COOH制![]() 、由氯乙烯制聚氯乙烯
、由氯乙烯制聚氯乙烯
D.由氯乙烷制乙烯、由溴乙烷制乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z三种短周期元素,X的气态氢化物化学式为H2X,此氢化物的式量与X最最高价氧化物的式量之比为17∶ 40,X原子核内质子数与中子数相等,Y与X可以形成离子化合物Y2X,Y的阳离子电子层结构与Ne相同,乙与X同周期,其气态单质是双原子分子,两原子共用1对电子。试回答:
(1)写出各元素符号:X__________、Y_________、Z__________。
(2)X离子的结构简图为____________________。X与Y形成的离子化合物的化学式为___________________,Z和氢形成的化合物的化学式为________________。
(3)Y单质在空气中燃烧的化学方程式为 __________________________________,生成物与水反应的化学方程式为_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上测量SO2、N2、O2混合气体中SO2含量的装置如图所示。反应管中装有碘的淀粉溶液。SO2和I2发生的反应(N2、O2不与I2反应)为SO2+I2+2H2O=H2SO4+2HI。
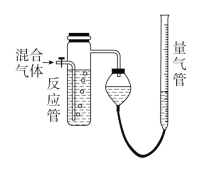
(1)混合气体进入反应管后,量气管内增加的水的体积等于________________(填气体的分子式)的体积。
(2)反应管内的溶液蓝色消失后,没有及时停止通气,则测得的SO2含量________(填“偏高”“偏低”或“不受影响”)。
(3)反应管内的碘的淀粉溶液也可以用________(填物质名称)代替。
(4)若碘溶液体积为Va mL,浓度为c mol·L-1。N2与O2的体积为Vb mL(已折算为标准状况下的体积)。用c、Va、Vb表示SO2的体积百分含量:____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com