
【题目】汽车尾气是城市空气的主要污染物,如何减少汽车尾气(CO,NOx等)的污染是重要的科学研究课题.
(1)已知:N2(g)+O2(g)═2NO(g)△H1
N2(g)+3H2(g)2NH3(g)△H2
2H2(g)+O2(g)═2H2O(g)△H3
则4NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H=(用含△H1、△H2、△H3的式子表达)
(2)汽车尾气中的CO,NOx都需要除去,有人设想按下列反应除去CO;2CO(g)=2C(s)+O2(g)已知该反应在任何温度下都不能自发进行,因此该设想便不能实现.由此判断该反应的△H0
目前,在汽车尾气系统中装置催化转化器可以减少CO,NO的污染,其化学反应方程式为
(3)可用活性炭还原法处理氮氧化物.有关反应的化学方程式为:C(s)+2NO(g)N2(g)+CO2(g)△H>0某研究小组向密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如表:
浓度/molL﹣1 | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
则,30min后,改变某一条件,平衡发生了移动,则改变的条件是;若升高温度,NO浓度将(填“增大”、“不变”或“减小”).
【答案】
(1)3△H3﹣2△H1﹣2△H2
(2)大于;2NO+2CO ![]() N2+2CO2
N2+2CO2
(3)减少CO2浓度;减小
【解析】解:(1)已知:①N2(g)+O2(g)═2NO(g)△H1②N2(g)+3H2(g)2NH3(g)△H2③2H2(g)+O2(g)═2H2O(g)△H3 , 利用盖斯定理,将③×3﹣②×2﹣①×2可得,4NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H=3△H3﹣2△H1﹣2△H2 ,
所以答案是:3△H3﹣2△H1﹣2△H2;(2)2CO(g)=2C(s)+O2(g),根据G=△H﹣T△S,G>0,不能实现,该反应是焓增、熵减的反应,则△H 大于0,催化条件下,CO、NO反应生成氮气和二氧化碳,方程式为2NO+2CO ![]() N2+2CO2 ,
N2+2CO2 ,
所以答案是:大于;2NO+2CO ![]() N2+2CO2;(3)根据表中数值知,NO、二氧化碳的浓度减小,氮气的浓度增大,说明改变条件是分离出二氧化碳物质,反应是吸热反应,升温平衡正向进行,一氧化氮浓度减小,
N2+2CO2;(3)根据表中数值知,NO、二氧化碳的浓度减小,氮气的浓度增大,说明改变条件是分离出二氧化碳物质,反应是吸热反应,升温平衡正向进行,一氧化氮浓度减小,
所以答案是:减少CO2浓度;减小.
【考点精析】根据题目的已知条件,利用反应热和焓变的相关知识可以得到问题的答案,需要掌握在化学反应中放出或吸收的热量,通常叫反应热.


科目:高中化学 来源: 题型:
【题目】在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见右图)。下列说法错误的是

A. a、b两处的混合气体成分含量相同,温度不同
B. c、d两处的混合气体成分含量相同,温度不同
C. 热交换器的作用是预热待反应的气体,冷却反应后的气体
D. c处气体经热交换后再次催化氧化的目的是提高SO2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知I-、Fe2+、SO2和Cl-均有还原性,它们在酸性溶液中还原性的强弱顺序为SO2>I->Fe2+>Cl-,下列反应不可能发生的是( )
A. Cl2+SO2+2H2O=H2SO4+2HCl B. 2Cl-+2Fe3+=2Fe2++Cl2↑
C. 2Fe3++2I-=2Fe2++I2 D. 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图可逆反应A+2B2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )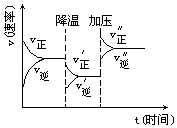
A.正反应是吸热反应
B.若A、B是气体,则D是液体或固体
C.改变物质浓度,平衡不会移动
D.A,B,C,D均为气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫酸钾、硫酸铝和硫酸组成的混合溶液中,c(H+)=0.2molL-1,c(Al3+)=0.4molL-1,c(SO42-)=0.8molL-1,则c(K+)为( )
A. 0.2molL-1 B. 0.3molL-1 C. 0.4molL-1 D. 0.5molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,每摩尔CuSO4能氧化P的物质的量为( )
A. 1/5 mol B. 2/5 mol C. 3/5mol D. 11/5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用质量分数为36.5%的浓盐酸(密度为1.16g/cm3)配制成1mol/L的稀盐酸。现实验室仅需要这种盐酸220mL。请回答下列问题:
(1)配制稀盐酸时,应选用容量为____mL的容量瓶;
(2)经计算需要量取______mL浓盐酸,在量取时宜选用下列量筒中的______。(填字母)
A.10mL B.25mL C.50mL D.100mL
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸其温度与室温一致后,沿玻璃棒注入所选用的容量瓶中。
②往容量瓶中小心加蒸馏水至液面接近环形标线1~2cm处,改用胶头滴管加蒸馏水,使溶液的凹面底部与瓶颈的环形标线相切。
③在盛盐酸的烧杯中注入蒸馏水几十毫升,并用玻璃棒搅动,使其混合均匀。
④用蒸餾水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
⑤配制完后,应将容量瓶中的稀盐酸转移到干燥洁净的试剂瓶中存放,盖好塞子并贴上标签。
上述操作中,正确的顺序是(填序号)__________________。
(4)在上述配制过程中,用刚刚用蒸馏水洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度是______(填“偏高”、“偏低”、“无影响”)。若定容时,俯视刻度线,则配制的稀盐酸浓度是_______(填“偏高”、“偏低”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、体积为2L的密闭容器中进行反应:2A(g) ![]() 3B(g)+C(g),若反应物在前20s由3mol降为1.8mol,则前20s的平均反应速率为( )
3B(g)+C(g),若反应物在前20s由3mol降为1.8mol,则前20s的平均反应速率为( )
A.v(B)=0.03 molL﹣1s﹣1
B.v(C)=0.06 molL﹣1s﹣1
C.v(C)=0.03 molL﹣1s﹣1
D.v(B)=0.045 molL﹣1s﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A (g)+xB(g)2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如图所示.下列说法中正确是( ) 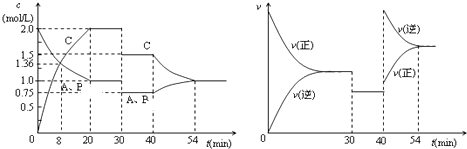
A.8min前A的平均反应速率为0.08mol/(Ls)
B.30min时扩大容器的体积,40min时升高温度
C.反应方程式中的x=1,正反应为吸热反应
D.30min和54min的反应的平衡常数相等4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com