
| A. | 17gOH-中含有的电子数为10NA | |
| B. | 标准状况下,lmol CCl4的体积约为22.4L | |
| C. | 1mol/LNa2CO3溶液中含有的Na+离子数为2NA | |
| D. | 常温常压下,1NA个CO2分子占有的体积为22.4L |
分析 A、求出氢氧根的物质的量,然后根据氢氧根中含10个电子来分析;
B、标况下四氯化碳为液态;
C、溶液体积不明确;
D、常温常压下,气体摩尔体积大于22.4L/mol.
解答 解:A、17g氢氧根的物质的量为1mol,而氢氧根中含10个电子,故1mol氢氧根中含10NA个电子,故A正确;
B、标况下四氯化碳为液态,故不能根据气体摩尔体积来计算其体积,故B错误;
C、溶液体积不明确,故溶液中的钠离子的个数无法计算,故C错误;
D、常温常压下,气体摩尔体积大于22.4L/mol,故NA个二氧化碳分子即1mol二氧化碳的体积大于22.4L,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 解释或结论 |
| A | 向某溶液中逐渐通入CO2气体,先出现白色沉淀,继续通入CO2气体,白色沉淀不溶解,证明该溶液中存在AlO2- | Al(OH)3是两性氢氧化物,不溶于碳酸溶液. |
| B | 某无色晶体加入NaOH浓溶液中并加热,产生的气体能使湿润的红色石蕊试纸变蓝 | 该晶体中一定有NH4+ |
| C | 用蒸馏法能将溶解在CCl4中的碘单质分离出来 | 因为碘易升华,故蒸馏时先分离出来 |
| D | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,则溶液变为黄色 | 氧化性:H2O2>F e3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强碱性溶液中:K+、Mg2+、Cl-、SO42- | |
| B. | 滴加石蕊试液显红色的溶液::K+、Al3+、Cl-、NO3- | |
| C. | 含有0.1mol•L-1Ca2+的溶液中:Na+、K+、CO32-、Cl- | |
| D. | 无色透明的酸性溶液中:MnO4-、K+、SO42-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把浑浊的液体倒入蒸发皿内加热 | |
| B. | 开始析出晶体后用玻璃棒搅拌 | |
| C. | 加入试剂的顺序为Na2CO3、BaCl2、NaOH、HCl | |
| D. | 用过滤法除去粗盐中的泥沙 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
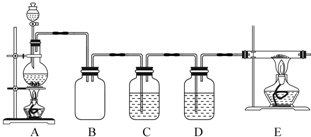
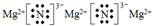 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com