
| A. | 弱电解质需要通电才能发生电离 | |
| B. | 醋酸达到电离平衡时,不存在:CH3COO-+H+?CH3COOH | |
| C. | H2SO4是共价化合物,所以它是弱电解质 | |
| D. | 电离平衡右移,电解质分子的浓度不一定减小 |
分析 A.弱电解质在水分子的作用下即可发生电离;
B.醋酸达到电离平衡时,存在CH3COOH?CH3COO-+H+,也存在CH3COO-+H+?CH3COOH;
C.共价化合物不一定是弱电解质;
D.增大电解质分子的浓度,电离平衡右移.
解答 解:A.弱电解质在水分子的作用下即可发生电离,不需要通电,故A错误;
B.醋酸达到电离平衡时,既存在分子电离成离子的过程,即存在CH3COOH?CH3COO-+H+,也存在离子结合生成分子的过程,即存在CH3COO-+H+?CH3COOH,故B错误;
C.共价化合物不一定是弱电解质,HCl、H2SO4等强酸都是强电解质,故C错误;
D.增大电解质分子的浓度,电离平衡右移,如向醋酸溶液中加冰醋酸,溶液中分子的浓度增大,电离平衡右移,故D正确.
故选D.
点评 本题考查了弱电解质的电离、电离平衡的移动,题目难度不大,侧重于基础知识的考查.


科目:高中化学 来源: 题型:填空题

| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Al (OH)3 |
| 开始沉淀时的pH | 7.0 | 1.9 | 3.4 |
| 完全沉淀时的pH | 9.0 | 3.2 | 4.7 |
| 实验操作 | 现象 | 结论 |
| 取适量产品于洁净烧杯中,加入适量蒸馏水,充分搅拌,静置,滤去沉淀. | 得黄棕色溶液 | |
| 取少量溶液于试管中,滴加溶液 ①0.05mol/L酸性高锰酸钾; | ②溶液不褪色; | 溶液中不含Fe2+ |
| 取少量溶液于试管中,滴加0.1 mol/L BaCl2溶液,再滴加20% HNO3溶液 | ③产生白色沉淀; | 溶液中含有SO${\;}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀氨水中滴加稀盐酸至恰好中和:[NH4+]═[Cl-] | |
| B. | 硫酸钠溶液中:[Na+]+[H+]═[OH-]+2[SO42-] | |
| C. | 0.1mol?L-1Na2S溶液中:[S2-]+[HS-]+[H2S]═[Na+] | |
| D. | 向CH3COONa溶液中加适量蒸馏水:[CH3COO-]与[OH-]都减小,[OH-]/[CH3COO-]也减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;Z2X4结构式
;Z2X4结构式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 给烧杯中的液体加热时,不需垫石棉网 | |
| B. | 用药匙或者纸槽把粉末状药品送人试管的底部 | |
| C. | 过滤时玻璃棒的末端应轻轻靠在三层的滤纸上 | |
| D. | 给试管中的液体加热时管口不要对着白己和别人,以免液体暴沸伤人 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
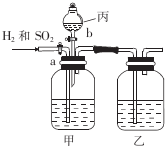 为了分离H2和SO2,并分别得到干燥的气体,某学生设计了一个实验装置.(a、b为活塞,且每个装置中的溶液均过量)
为了分离H2和SO2,并分别得到干燥的气体,某学生设计了一个实验装置.(a、b为活塞,且每个装置中的溶液均过量)查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com