
����Ŀ��̼����[Ce2��CO3��3]Ϊ��ɫ��ĩ��������ˮ����Ҫ������������м仯��������ɷ�̼���澫����ͼ1�����Ƶã� 
��1����ͼ2��һ��ϡ��Ԫ���棨Ce����Ԫ�����ڱ��е���Ϣʾ��ͼ������ԭ�ӵ��������� �� ��̼����Ļ�ѧʽΪCeFCO3 �� �û������У�Ce�Ļ��ϼ�Ϊ��
��2���������ɵ��滯����Ϊ�������棨CeO2�����������ʱ������Ӧ�����ӷ���ʽΪ��
��3���Լ�X��
��4����֪298Kʱ��Ksp[Ce��OH��4]=1��10��29 �� Ce��OH��4���ܶȻ�����ʽΪKsp=��Ϊ��ʹ��Һ��Ce4+������ȫ�������pHΪ���ϣ�
��5��ȡijCe��OH��4��Ʒ1.00g����������Ϊ97%�����������ܽ����0.1000molL��1��FeSO4��Һ�ζ����յ㣨�汻��ԭ��Ce3+������Ҫ�μӱ���Һ�����mL�����������ữ�����0.1000molL��1��FeCl2��Һ�ζ���Ʒ�Ӷ��ⶨCe��OH��4��Ʒ������������������������ȷ����ⶨ��Ce��OH��4��Ʒ�������������ƫ�ߡ�����ƫ�͡����䡱����
���𰸡�
��1��58��+3
��2��2CeO2+H2O2+6H+=2Ce3++O2��+4H2O
��3��Na2CO3
��4��c��Ce4+��?[c��OH����]4��8
��5��46.6��ƫ��
���������⣺̼����[Ce2��CO3��3]Ϊ��ɫ��ĩ��������ˮ�����ɷ�̼���澫�������������ɶ������棨CeO2�����������棨CeO2���������������±���ԭΪ+3�۵����Σ�ͨ������Na2CO3��Һ���Ӷ��Ƶ�̼����[Ce2��CO3��3]��
��1.����������Ԫ�����ڱ���λ�ÿ�֪������58��Ԫ�أ���������Ϊ58���������и�Ԫ�ػ��ϼ�֮��Ϊ0��CeFCO3��Ce�Ļ��ϼ�Ϊx����x+����1��+��+4��+����2����3=0��x=+3��
���Դ��ǣ�58��+3��
��2.�����������CeΪ+4�ۣ������ʱ������CeO2 ���ܽ⣬�ұ�˫��ˮ��ԭΪ��+3�۵�Ce3+ �� �����������·���������ԭ��Ӧ������ʽΪ��2CeO2+H2O2+6H+=2Ce3++O2��+4H2O�����Դ��ǣ�2CeO2+H2O2+6H+=2Ce3++O2��+4H2O��
��3.��������������벻����õ�����Ce3+����Һ������Na2CO3��Һ���кͣ�2������Һ��ʹCe3+ת��ΪCe2��CO3��3�������������˵õ�Ce2��CO3��3 ��
���Դ��ǣ�Na2CO3��
��4.���ܶȻ�Ϊ��Һ����Ũ�ȵ��ݴη��ij˻���Ce��OH��4���ܶȻ�����ʽΪKsp=c��Ce4+��[c��OH����]4 �� ʹ��Һ��Ce4+������ȫ������������Һ�е�c��Ce4+��С��1��10��5molL��1 ��
��c��OH������ ![]() =
= ![]() mol/L=1��10��6mol/L����pH=8��
mol/L=1��10��6mol/L����pH=8��
���Դ��ǣ�c��Ce4+��[c��OH����]4��8��
��5.��Ce��OH��4��Ʒ���������ܽ��������Ce4+ �� �����û�ԭ���ζ�����Һ��Ce4+�����Ce3+ �� ��Fe2+����������Fe3+ �� ���Ը��ݵ��ӵ����غ���㣬n[Ce��OH��4]=n��FeSO4��=cV=0.1000 molL��1��V��10��3L= ![]() ��V=46.6�����Ȼ��������������������������ܱ�Ce4+���������Ի�ʹ�Ȼ����������ƫС�����Բ�õ�Ce��OH��4��Ʒ����������ƫ�ͣ�
��V=46.6�����Ȼ��������������������������ܱ�Ce4+���������Ի�ʹ�Ȼ����������ƫС�����Բ�õ�Ce��OH��4��Ʒ����������ƫ�ͣ�
���Դ��ǣ�46.6��ƫ�ͣ�


 ѧ�����νӽ̲��Ͼ���ѧ������ϵ�д�
ѧ�����νӽ̲��Ͼ���ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�ָ������Ĺ�̬﮵����﮳����ӹ�̬���壨���ΪLi30GeP2S12��Ϊ����ʣ���﮵�����ک�100����100��֮��ij����¶ȷ�Χ�ڹ���������˵������ȷ���ǣ� ��
A.Li��ԭ�ӽṹʾ��ͼΪ ![]()
B.ԭ�Ӱ뾶��P��S
C.���ԣ�H3PO4��H2SO4
D.Li��Ge��P��S�����ڶ�����Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����ĩ������Na2O��Na2O2��Na2CO3��NaHCO3��NaCl�е�һ�ֻ�����ɡ����÷�ĩ�����������ᷴӦ������X�ݳ���Xͨ��������NaOH��Һ�������С(ͬ�¡�ͬѹ�²ⶨ)��ʣ�����塣����ԭ����Ϸ�ĩ�ڿ������þƾ��Ƽ��ȣ�Ҳ������ų�����ʣ��������������ԭ��Ϸ�ĩ�������������ж���ȷ����( )
�ٷ�ĩ��һ����Na2O��Na2O2��NaHCO3
�ڷ�ĩ��һ��������Na2CO3��NaCl
�۷�ĩ��һ��������Na2O��NaCl
�����϶���ĩ���Ƿ���Na2CO3��NaCl
A���٢� B���ڢ� C���ۢ� D���٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���ѷ���һ����������ӣ��仯ѧʽΪH3 �� ����ͬ�����£���������H3��H2��ͬ���ǣ� ��
A.ԭ����
B.������
C.���
D.���ʵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڹ�̬��������������У����¹����H2O��CO2��������Ʊ�H2��CO��һ���µ���Դ���÷�ʽ������ԭ����ͼ��ʾ������˵������ȷ���ǣ� �� 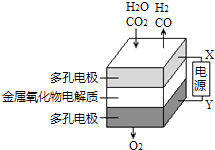
A.X�ǵ�Դ�ĸ���
B.�����ķ�Ӧʽ�ǣ�H2O+2e���TH2+O2�� �� CO2+2e���TCO+O2��
C.�ܷ�Ӧ�ɱ�ʾΪ��H2O+CO2 ![]() H2+CO+O2
H2+CO+O2
D.�������������ɵ���������ʵ���֮����1��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��SO2��NOx���Ǵ�����Ⱦ�
��1�������ŷŵ�β���к�CO��NO����������������ʱ������NO��CO��ͨ����ת����ת��Ϊ��������Ⱦ�����壬�÷�Ӧ�Ļ�ѧ����ʽ��
��2����ȡ��ԭ������̿�ۿɽ��������ﻹԭ��
��֪��N2��g��+O2��g���T2NO��g����H=+180.6kJmol��1��C��s��+O2��g���TCO2��g����H=��393.5kJmol��1
��ӦC��s��+2NO��g���TCO2��g��+N2��g����H=kJmol��1 ��
��3����NO2�������N2Ҫ�ҵ��ʺϵ�����G���ʵ��ķ�Ӧ������GӦΪ����д������������ԭ����������ʽ��X����Ϊ����Ⱦ�����ʣ�ϵ��n����Ϊ0��NO2+G ![]() N2+H2O+nX ��δ��ƽ�ķ�Ӧʽ����
N2+H2O+nX ��δ��ƽ�ķ�Ӧʽ����
���л������У�����������Ӧʽ�е�G������д��ĸ����
a��NH3b��CO2c��SO2d��CH3CH2OH
��4�����ð�ˮ���Խ�SO2��NO2���գ�ԭ����ͼ1��ʾ��NO2�����յ����ӷ���ʽ�� 
��5������ͼ2��ʾװ�ã��缫��Ϊ���Ե缫��Ҳ������SO2 �� ���������ų�����Һ����NO2 �� 
��b���ĵ缫��ӦʽΪ��
���ڼ��������£��������ų�����Һ����NO2 �� ʹ��ת��Ϊ�����壬ͬʱ��SO32�����ɣ��÷�Ӧ���ӷ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������ˮ�к�1.00��10��2mol/L��Cr2O72�� �� �䶾�Խϴ�ij�о���ѧϰС��Ϊ�˱��Ϊ��������ˮ�����õ����Բ���Cr0.5Fe1.5FeO4 �� �������ͼʵ�飬����˵����ȷ���ǣ� �� 
A.���ݵڢٲ���Ӧ��֪��ԭ�ԣ�Cr3+����Fe2+
B.�ڢڲ����˵õ�����������Ҫ�ɷ�ΪCr��OH��3��Fe��OH��2 �� ����Fe��OH��3
C.��ʹ1L�÷�ˮ�е�Cr2O72����ȫת��ΪCr0.5Fe1.5FeO4 �� ��������Ҫ����27.8g FeSO47H2O
D.�ڢ۲����±��չ����õ�����Ҫʵ�����������ڹ������ʵ��У��ƾ��ơ�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ۺ����ü������ڽ�Լ��Դ���������ڱ���������ʵ�������÷Ͼɻ�ͭ��Cu��Zn�Ͻ𣬺���������Fe���Ʊ��������壨CuSO45H2O����������ZnO���Ʊ�����ͼ��ͼ��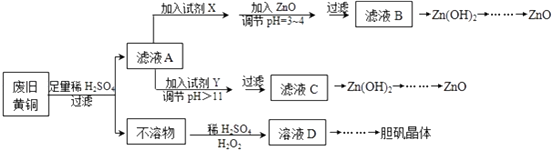
��֪��Zn���������������Al����������������ƣ�pH��11ʱZn��OH��2������NaOH��Һ����[Zn��OH��4]2�� �� ��ͼ���г��˼������������������������pH����ʼ������pH����������Ũ��Ϊ1.0molL��1���㣩��
Fe3+ | Fe2+ | Zn2+ | |
��ʼ������pH | 1.1 | 5.8 | 5.9 |
s������ȫ��pH | 3.0 | 8.8 | 8.9 |
��ش��������⣺
��1���Լ�X������ �� �������� ��
��2������ZnO����pH=3��4��Ŀ���� ��
��3���ɲ�����������ҺD�Ļ�ѧ����ʽΪ ��
��4������ҺD�Ƶ��������������Ҫ���������� ��
��5�������Լ�����ΪY�Լ����� ��
A��ZnO B��NaOH C��Na2CO3D��ZnSO4
������ҺC����μ�������ֱ��������������������� ��
��6���ⶨ��������Ĵ��ȣ���������I��������Ӧ�����������ʣ���ȷ��ȡ0.5000g��������������ƿ�У�������ˮ�ܽ⣬�ټ������KI����0.1000molL��1Na2S2O3����Һ�ζ����յ㣬����Na2S2O3����Һ19.40mL����֪�������ζ������е����ӷ���ʽ���£�2Cu2++4I���T2CuI����ɫ����+I2 �� I2+2S2O32���T2I��+S4O62��
�ٵ�������Ĵ���Ϊ ��
���ڵζ������о���ҡ������Һ���⽦����ƿ��������õĴ��Ƚ������ƫ�ߡ�����ƫ�͡����䡱����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com