
【题目】在室温下,下列五种溶液:①0.1 mol/L NH4Cl溶液,②0.1 mol/L CH3COONH4溶液,③0.1 mol/L NH4HSO4溶液,④0.1 mol/L 氨水,⑤0.1 mol/L NH3·H2O和0.1 mol/L NH4Cl混合液(显碱性)。请根据要求填写下列空白:
(1)溶液①呈____________性(填“酸”、“碱”或“中”),其原因是___________(用离子方程式表示)
(2)在上述①、②、③、④溶液中c(NH4+)浓度由大到小的顺序是_________。(填序号)
(3)在溶液⑤中,各离子浓度大小顺序为___________。
(4)室温下,测得溶液②的pH=7,则 CH3COO—与NH4+浓度的大小关系是c(CH3COO—)________c(NH4+)(填“>”、“<”或“=”)。
(5)常温下,0.1 mol/ L CH3COOH溶液加水稀释过程中,下列表达式的数值变大的是____________(填字母)。
A. c(H+) B. c(H+)/ c(CH3COOH) C. c(H+)·c(OH-)
D. c(OH-)/ c(H+) E. c(H+)·c(CH3COO-) / c(CH3COOH)
(6)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为____________。
【答案】酸 NH4++H2O![]() NH3·H2O+H+ ③>①>②>④ c(NH4+)>c(Cl-)>c(OH-)>c(H+) = BD 10:1
NH3·H2O+H+ ③>①>②>④ c(NH4+)>c(Cl-)>c(OH-)>c(H+) = BD 10:1
【解析】
(1)在盐溶液中,形成盐的酸和碱中谁的性质强,溶液就表现谁的性质;
(2)比较c(NH4+)时,可以NH4Cl作为参照物,凡是电解质能完全电离出NH4+的,都比部分电离出NH4+的浓度大;在完全电离出NH4+的盐中,产生能促进NH4+水解的盐,溶液中c(NH4+)浓度小,产生能抑制NH4+水解的盐,溶液中c(NH4+)浓度大。
(3)依据电离或水解的程度大小,确定离子浓度的相对大小。
(4)可依据电荷守恒进行计算。
(5)可从CH3COOH加水稀释后电离度的变化、离子浓度的变化两个方面去分析。
(6)利用酸碱溶液中H+与OH-物质的量相等进行计算。
(1)溶液①为强酸弱碱盐,溶液呈酸性,其原因是NH4++H2O![]() NH3·H2O+H+;答案为:酸;NH4++H2O
NH3·H2O+H+;答案为:酸;NH4++H2O![]() NH3·H2O+H+。
NH3·H2O+H+。
(2)在上述①、②、③、④溶液中,①0.1 mol/L NH4Cl溶液、②0.1 mol/L CH3COONH4溶液、③0.1 mol/L NH4HSO4溶液中的溶质都是能发生水解的强电解质,NH4+的水解程度不同,③中NH4+的水解受到抑制,②中NH4+水解受到促进,而④中0.1 mol/L 氨水只发生部分电离,产生的c(NH4+)最小,所以浓度由大到小的顺序是③>①>②>④;答案为:③>①>②>④。
(3)溶液⑤为0.1 mol/L NH3·H2O和0.1 mol/L NH4Cl混合液,因为其显碱性,故NH3·H2O的电离程度大于NH4+的水解程度,c(NH4+)>c(Cl-)=0.1 mol/L,NH3·H2O为弱电解质,其电离的程度较小,所以各离子浓度大小顺序为c(NH4+)>c(Cl-)>c(OH-)>c(H+);答案为:c(NH4+)>c(Cl-)>c(OH-)>c(H+)。
(4)依据电荷守恒,c(CH3COO-) +c(OH-) == c(NH4+) +c(H+),因为c(OH-)= c(H+),所以c(CH3COO-) == c(NH4+),答案为:= 。
(5)A. 0.1 mol/ L CH3COOH溶液加水稀释过程中,c(H+) 不断减小,A不合题意;
B.加水稀释过程中,n(H+)增大,n(CH3COOH)减小,所以c(H+)/ c(CH3COOH)增大,B符合题意;
C. 因为温度不变,所以c(H+)·c(OH-)不变,C不合题意;
D.在稀释过程中,n(OH-)增大,n(H+)减小,所以c(OH-)/ c(H+) 增大,D符合题意;
E .温度不变,醋酸的电离平衡常数不变,所以 c(H+)·c(CH3COO-) / c(CH3COOH)不变,E不合题意;答案为:BD。
(6)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则10-5V(NaOH)=10-4V(H2SO4),从而得出V(NaOH):V(H2SO4)=10-4:10-5=10:1;答案为:10:1。


科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________________________________________、_____________________________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按下图连接好装置进行实验。

①仪器B的名称是________。
②将下列实验操作步骤正确排序_____________(填标号);重复上述操作步骤,直至A恒重,记为m3g。
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭K1和K2
d.打开K1和K2,缓缓通入N2
e.称量A
f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x=________(列式表示)。若实验时按a、d次序操作,则使x________(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1000mol·L-1的NaOH溶液分别滴定20.00mL均为0.1000mol·L-1的三种酸HX、HY、HZ ,滴定曲线如图所示。下列说法错误的是
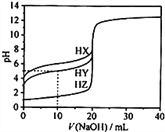
A. HZ是强酸,HX、HY是弱酸
B. 根据滴定曲线,可得Ka(HY)≈10-5
C. 将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+)
D. 将上述HY与HZ溶液等体积混合达到平衡时:C(H+)=c(OH-)+c(Z-)+c(Y-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍能形成多种不同的化合物。图1是镍的一种配合物的结构,图2是一种镍的氧化物的晶胞。判断下列说法正确的是

A.图2可能表示的是NiO的晶胞
B.图1中C、N、O的第一电离能C>N>O
C.图2中离镍原子最近的镍原子数共为8个
D.图1分子中存在的化学键有共价键、配位键、氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,将浓度均为
时,将浓度均为![]() 、体积分别为
、体积分别为![]() 和
和![]() 的
的![]() 溶液与
溶液与![]() 溶液按不同体积比混合,保持
溶液按不同体积比混合,保持![]() ,
,![]() 、
、![]() 与混合液的
与混合液的![]() 的关系如图所示,下列说法不正确的是( )
的关系如图所示,下列说法不正确的是( )
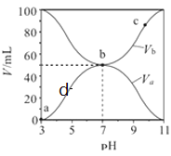
A.![]() 的数量级约为
的数量级约为![]()
B.b点时![]()
C.a、b、d几点中,水的电离程度![]()
D.![]() 点过程中,可能存在
点过程中,可能存在![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳族元素的单质及其化合物是一类重要物质。请回答下列问题:
(1)锗(Ge)是用途很广的半导体材料,基态Ge原子的核外电子中,有_____个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是________________________________________。
(3)GeCl4可水解生成一种氧化物和一种无氧酸,其化学反应方程式为:_______________。
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是____________________。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为______,微粒之间存在的作用力是_______。
(6)合成氮化碳是一种硬度比金刚石还大的晶体,氮化碳的晶体类型为________,该晶体中微粒间的作用力是____________。
(7)COCl2俗称光气,分子中C原子采取sp2杂化成键,光气分子的结构式为____________,其中碳氧原子之间共价键是________(填序号)。
a.2个σ键b.2个π键c.1个σ键,1个π键
(8) CaC2中C22与O22+互为等电子体,O22+的电子式可表示为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是
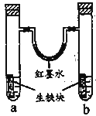
A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是:![]()
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物![]() 分子中含有多种官能团,其结构简式为:
分子中含有多种官能团,其结构简式为: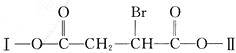
![]() 其中Ⅰ、Ⅱ为未知部分
其中Ⅰ、Ⅱ为未知部分![]() 。为推测X的分子结构,进行如图转化:
。为推测X的分子结构,进行如图转化:
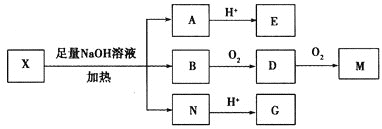
已知![]() 核磁共振氢谱显示有两组峰,峰面积之比为
核磁共振氢谱显示有两组峰,峰面积之比为![]() ;向G的水溶液中滴入
;向G的水溶液中滴入![]() 溶液发生显色反应;E、M都能与
溶液发生显色反应;E、M都能与![]() 溶液反应。请回答:
溶液反应。请回答:
![]() 的结构简式为________________________;D分子中所含官能团的结构简式是____________。B的系统命名法名称为________。
的结构简式为________________________;D分子中所含官能团的结构简式是____________。B的系统命名法名称为________。
![]() 可以发生的反应有
可以发生的反应有![]() 选填序号
选填序号![]() ________。
________。
①加成反应 ②消去反应 ③氧化反应 ④取代反应
![]() 两分子E在一定条件下可生成含有六元环的有机化合物,写出E发生此反应的化学方程式:_____________________________________。
两分子E在一定条件下可生成含有六元环的有机化合物,写出E发生此反应的化学方程式:_____________________________________。
![]() 若在X分子结构中,Ⅱ里含有能与氯化铁溶液发生显色反应的官能团,且G与溴水反应生成的一溴代物有2种,则X与足量NaOH溶液反应的化学方程式为:______________________________________。
若在X分子结构中,Ⅱ里含有能与氯化铁溶液发生显色反应的官能团,且G与溴水反应生成的一溴代物有2种,则X与足量NaOH溶液反应的化学方程式为:______________________________________。
![]() 是相对分子质量比E大14的链状有机化合物,组成元素和E相同,F分子中只含2种官能团,
是相对分子质量比E大14的链状有机化合物,组成元素和E相同,F分子中只含2种官能团,![]() 与足量金属钠反应能放出
与足量金属钠反应能放出![]() 氢气,核磁共振氢谱显示F有四组吸收峰,则符合条件的F的结构简式为
氢气,核磁共振氢谱显示F有四组吸收峰,则符合条件的F的结构简式为![]() 说明:同一个碳上不能连有多个羟基
说明:同一个碳上不能连有多个羟基![]() __________________。
__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林(化合物L)是人们熟知的解热镇痛药物。一种长效、缓释阿司匹林(化合物P)的合成路线如下图所示:

已知:①HC≡CH+RCOOH![]()
![]()
②RCOOR’+R”OH![]() RCOOR”+R’OH(R、R’、R”代表烃基)
RCOOR”+R’OH(R、R’、R”代表烃基)
请回答:
(1)A中的官能团是____________________。
(2)C的结构简式是____________________。
(3)D→E的反应类型是____________________。
(4)E→G的化学方程式是______________________________________。
(5)已知:H是芳香族化合物。在一定条件下2B → K + H2O,K的核磁共振氢谱只有一组峰。J→L的化学方程式是____________________。
(6)L在体内可较快转化为具有药效的J,而化合物P与L相比,在体内能缓慢持续释放J。
① 血液中J浓度过高能使人中毒,可静脉滴注NaHCO3溶液解毒。请用化学方程式解释NaHCO3的作用:______________________________________________________________。
② 下列说法正确的是______(填字母)。
a.P中的酯基在体内可缓慢水解,逐渐释放出J
b.P在体内的水解产物中没有高分子化合物
c.将小分子药物引入到高分子中可以实现药物的缓释功能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com