
用铝箔包起0.1 mol金属钠,用针扎出些小孔,放入水中,完全反应,用排水集气法收集产生的气体,则收集到的气体为(标准状况)( )
A.O2和H2的混合气体 B.1.12 L H2w
C.大于1.12 L H2 D.小于1.12 L H2
科目:高中化学 来源: 题型:
去甲肾上腺素可以调控动物机体的植物性神经功能,其结构简式如图所示。下列说法正确的是( )
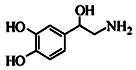
A.每个去甲肾上腺素分子中含有3个酚羟基
B.1mol去甲肾上腺素最多能与2molBr2
C.甲肾上腺素分子不能与饱和的碳酸氢钠溶液发生反应
D.去甲肾上腺素既能与盐酸反应,又能与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.强电解质溶液一定比弱电解质溶液的导电性强
B.强电解质的稀溶液中不存在溶质分子
C.强电解质都是离子化合物,而弱电解质都是共价化合物
D.不同的弱电解质只要物质的量的浓度相同,电离程度也相同
查看答案和解析>>
科目:高中化学 来源: 题型:
某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL的容量瓶中定容配成250 mL烧碱溶液
B.用移液管移取25 mL烧碱溶液于锥形瓶中并滴几滴甲基橙指示剂
C.在天平上准确称取烧碱样品W g,在烧杯中用蒸馏水溶解
D.将物质的量浓度为c的标准硫酸溶液装入酸式滴定管,调节液面,记下开始读数为V1
E.在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:
(1)正确操作步骤的顺序是______→______→______→D→______(均用字母填写)。
(2)滴定管的读数应注意
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(3)E中在锥形瓶下垫一张白纸的作用是
________________________________________________________________________
________________________________________________________________________。
(1) D步骤中液面应调节到
________________________________________________________________________
__________,尖嘴部分应__________________________________________________。
(2) 滴定终点时锥形瓶内溶液的pH约为_____________________________________,
终点时颜色变化是_______________________________________________________。
(6)若酸式滴定管不用标准硫酸润洗,在其他操作均正确的前提下,会对测定结果(指烧碱的纯度)有何影响?______(填“偏高”、“偏低”或“不变”)。
(7)该烧碱样品纯度的计算式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将1 mol Na和1 mol Al的混合物投入足量水中,产生气体在标准状况下的体积为( )
A.11.2 L B.22.4 L
C.33.6 L D.44.8 L
查看答案和解析>>
科目:高中化学 来源: 题型:
已知
NaCl(s)+H2SO4(浓)===NaHSO4+HCl↑
现在117 g NaCl晶体和足量的浓硫酸完全反应。求:
(1)产生的HCl在标准状况时的体积为多少?
(2)将所得HCl气体溶于100 g水中,若所得盐酸的密度为1.1 g·cm-3,则盐酸的物质的量浓度为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定量的密闭容器中进行反应:N2(g)+3H22NH3(g)。已知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L。当反应达到平衡时,可能存在的数据是( )
A.N2为0.2 mol/L,H2为0.6 mol/L
B.N2为0.15 mol/L
C.N2、H2均为0.18 mol/L
D.NH3为0.4 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有________;
(2)硫酸铜溶液可以加快氢气生成速率的原因是________________________________________________________________________________________________________________________________________________。
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是__________________________;
(4)要加快上述实验中气体产生的速率,还可采取的措施有
________________________________________________________________________________________________________________________________________________(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 | A | B | C | D | E | F |
| 4 mol·L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中V1________,V6________,V9________;
②反应一段时间后,实验A中的金属呈________色,实验E中的金属呈________色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,在一个容积为2 L的密闭容器中加入0.8 mol A2气体和0.6 mol B2气体反应达平衡生成1mol AB气体并释放出热量,反应中各物质的浓度随时间的变化情况如图所示。下列说法不正确的是
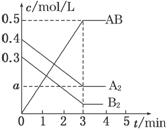
A.图中a点的值为0.15 B.该反应的平衡常数K=0.03
C.温度升高,平衡常数K值减小 D.平衡时A2的转化率为62.5%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com