
分析 (1)所含元素化合价升高的反应物为还原剂,发生氧化反应,得到氧化产物,所含元素化合价降低的反应物为氧化剂,发生还原反应,得到还原产物;
(2)反应中N元素化合价部分降低,部分未变,硝酸表现氧化性、酸性;
(3)根据N元素化合价变化计算转移电子物质的量.
解答 解:(1)反应中硝酸中N元素化合价由+5价降低为二氧化氮中+4价,故HNO3(浓)是氧化剂,NO2是还原产物,Cu元素化合价升高为硝酸铜中+2价,故Cu是还原剂,Cu(NO3)2是氧化产物,
故答案为:HNO3(浓);Cu(NO3)2;Cu;NO2;
2)反应中N元素化合价部分降低,部分未变,硝酸表现氧化性、酸性,
故答案为:氧化、酸;
(3)NO2的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,则转移电子为0.5mol×(5-4)=0.5mol,
故答案为:0.5.
点评 本题考查氧化还原反应基本概念与计算,比较基础,注意根据元素化合价变化理解氧化还原反应基本概念.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:解答题
 某课外兴趣小组欲利用如图所示装置自制氢氧燃料电池.
某课外兴趣小组欲利用如图所示装置自制氢氧燃料电池.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 按如图进行电解实验(A、B、C、D均为惰性电极).
按如图进行电解实验(A、B、C、D均为惰性电极).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol某气体的体积是22.4L,该气体所处的状况不一定是标准状况. | |
| B. | 非标准状况下,1molO2的体积必定不是22.4L | |
| C. | 某物质含有阿伏加德罗常数个微粒,该物质在标准状况下的体积为22.4L | |
| D. | 标准状况下,1molH2和O2的混合气体的体积不一定为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
| c(SO2)/mol•L-1 | 0.04 | 0.024 | 0.012 | 0.006 | 0.004 | 0.002 | 0.002 |
| c(O2)/mol•L-1 | 0.04 | 0.032 | 0.026 | 0.023 | 0.022 | 0.021 | 0.021 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验①和②均能证明K2Cr2O7溶液中存在上述平衡 | |
| B. | 实验②能说明氧化性:Cr2O72->Fe3+ | |
| C. | CrO42- 和Fe2+在酸性溶液中可以大量共存 | |
| D. | 稀释K2Cr2O7溶液时,溶液中各离子浓度均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
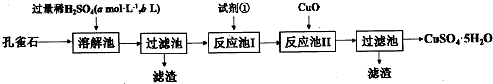
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com