
 Ⅰ、碘钨灯具有使用寿命长、节能环保等优点.一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+I2(g)?WI2(g).
Ⅰ、碘钨灯具有使用寿命长、节能环保等优点.一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+I2(g)?WI2(g).| △n |
| V△t |
| Ksp |
| c(CO 32-) |


科目:高中化学 来源: 题型:
| A、酒精灯失火后,立即用水扑灭 |
| B、金属钠失火,立即用泡沫灭火器灭火 |
| C、苯酚沾在手上,立即用氢氧化钠溶液洗涤 |
| D、不慎将碱溅到皮肤上,立即用水冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| n(H2) |
| n(CO2) |
| n(H2) |
| n(CO2) |
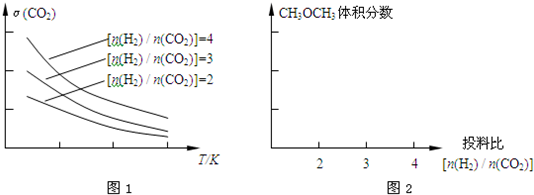
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
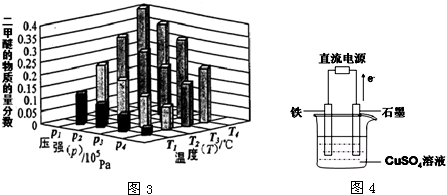
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 三氯化铁是中学化学实验室中必不可少的重要试剂.某兴趣小组利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备 FeCl3?6H2O,该同学设计的实验装置如图所示,A中放有m克废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中加过量的稀盐酸,此时溶液呈浅绿色,再打开b 进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使多余HNO3分解,再降温结晶得FeCl3?6H2O晶体.
三氯化铁是中学化学实验室中必不可少的重要试剂.某兴趣小组利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备 FeCl3?6H2O,该同学设计的实验装置如图所示,A中放有m克废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中加过量的稀盐酸,此时溶液呈浅绿色,再打开b 进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使多余HNO3分解,再降温结晶得FeCl3?6H2O晶体.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com