
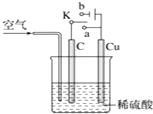
 铜与稀硫酸不反应,某校实验小组的同学在老师的指导下设计了下列装置,实现了铜与稀硫酸的反应.请回答下列问题:
铜与稀硫酸不反应,某校实验小组的同学在老师的指导下设计了下列装置,实现了铜与稀硫酸的反应.请回答下列问题:分析 (1)通入空气时,K与a相连,可以构成原电池,铜为负极,碳棒为正极,结合原电池原理写出总反应的化学方程式;
(2)K与b相连时构成电解池,铜与电源正极相连,为电解池的阳极,则铜失去电子生成铜离子,碳棒上氢离子得到电子生成氢气,据此写出电极反应式及总反应的离子方程式;
(3)电镀中镀层铜与电源的正极相连,镀件与电源的负极相连,由此分析解答.
解答 解:(1)在通入空气的同时,将开关K与a相连可构成原电池,铜为负极,铜失去电子生成铜离子,碳棒为正极,氧气得到电子生成水,电极的反应式为:O2+4H++4e-=2H2O,电池总反应为:2Cu+O2+2H2SO4=2CuSO4+2H2O,原电池工作时阳离子向正极移动,即向C移动,
故答案为:a;O2+4H++4e-=2H2O;2Cu+O2+2H2SO4=2CuSO4+2H2O;C;
(2)不通入空气时,K与b相连构成了电解池,铜为阳极,失去电子发生氧化反应:Cu-2e-=Cu2+,碳棒为阴极,氢离子得到电子生成氢气,电解总反应为:Cu+2H+=Cu2++H2↑,若标准状况下产生2.24L气体,即物质的量为0.1mol,则电路中转移的电子为0.2mol,
故答案为:b;Cu-2e-=Cu2+;Cu+2H+=Cu2++H2↑;0.2mol;
(3)镀层金属铜与电源的正极相连,镀件铁与电源的负极相连,能实现在在Fe上镀Cu,但电镀过程中会有氢气生成,导致镀层中有气泡,而导致镀层不牢固,故答案为:正确,不牢固,在电镀过程中会有氢气生成,导致镀层中有气泡.
点评 本题考查了原电池、电解池工作原理,题目难度中等,明确原电池和电解池工作原理为解答关键,注意掌握书写电极反应式的方法,试题培养了学生的分析能力及灵活应用能力.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:实验题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(NH3)=0.03 mol/(L•min) | B. | v(NH3)=0.02 mol/(L•min) | ||
| C. | v(NH3)=0.17 mol/(L•min) | D. | v(NH3)=0.01 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol葡萄糖最多可以与5mol金属钠反应放出氢气 | |
| B. | 1mol葡萄糖最多可以与5mol乙酸发生取代反应 | |
| C. | 能发生银镜反应 | |
| D. | 可与小苏打溶液反应冒出气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素b、c的离子半径大小为:c<b | |
| B. | a和b、c均能形成电子数为18的分子 | |
| C. | 元素a、b、c各自最高和最低化合价的代数和分别为0、2、4 | |
| D. | d和其他3种元素均能形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、HCO3-、SO42-、Br- | B. | Mg2+、Na+、SO42-、Cl- | ||
| C. | Na+、Cu2+、SO42-、NO3- | D. | Na+、Ba2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1 稀硫酸中含有SO42-离子个数为0.1NA | |
| B. | 0.1molNa2O2与CO2完全反应,转移电子数为0.2 NA | |
| C. | 常温常压下,46 g的NO2和46g 的N2O4含有的原子数相等 | |
| D. | 标准状况下,22.4L SO3所含的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
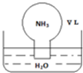 标准状况下,将体积为VL的圆底烧瓶中充满氨气,倒扣在含有足量水的水槽中(如图所示),实验完毕后立即将烧瓶从水槽中取出(无NH3•H2O、NH4+、NH3)扩散到水槽中),所得溶液的密度为ρg•cm-3.下列说法正确的是( )
标准状况下,将体积为VL的圆底烧瓶中充满氨气,倒扣在含有足量水的水槽中(如图所示),实验完毕后立即将烧瓶从水槽中取出(无NH3•H2O、NH4+、NH3)扩散到水槽中),所得溶液的密度为ρg•cm-3.下列说法正确的是( )| A. | 条件不足,不能计算所得溶液的物质的量浓度 | |
| B. | 所得溶液中,n(NH3•H2O)+n(NH4+)+n(NH3)=$\frac{V}{22.4}$ | |
| C. | 所得溶液的质量分数为$\frac{17ρ}{22400}$ | |
| D. | 水最终不可能充满整个烧瓶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com