
 ŌŚČŻ»żĪŖ1.00LµÄČŻĘ÷ÖŠ£¬ĶØČėŅ»¶ØĮæµÄN2O4£¬·¢Éś·“Ó¦N2O4£Øg£©?2NO2£Øg£©£¬ĖęĪĀ¶ČÉżøߣ¬»ģŗĻĘųĢåµÄŃÕÉ«±äÉī£®
ŌŚČŻ»żĪŖ1.00LµÄČŻĘ÷ÖŠ£¬ĶØČėŅ»¶ØĮæµÄN2O4£¬·¢Éś·“Ó¦N2O4£Øg£©?2NO2£Øg£©£¬ĖęĪĀ¶ČÉżøߣ¬»ģŗĻĘųĢåµÄŃÕÉ«±äÉī£®·ÖĪö £Ø1£©ĖęĪĀ¶ČµÄÉżøߣ¬»ģŗĻĘųĢåµÄŃÕÉ«±äÉī£¬»ÆŃ§Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬¾Ż“ĖÅŠ¶Ļ£»·“Ó¦ĖŁĀŹĄūÓĆ¹«Ź½v=$\frac{”÷c}{”÷t}$¼ĘĖćµĆµ½£»»ÆŃ§Ę½ŗā³£ŹżĄūÓĆ»ÆŃ§Ę½ŗā³£Źż±ķ“ļŹ½¼ĘĖć£»
£Ø2£©¢ŁN2O4µÄÅØ¶Č½µµĶ£¬Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬ÓÉÓŚÕż·“Ó¦·½ĻņĪüČČ£¬T£¾100”ę£»
¢Ś¼ĘĖćT”ꏱĮ½ÖÖĪļÖŹµÄÅØ¶Č£¬¼ĘĖćµĆµ½»ÆŃ§Ę½ŗā³£Źż£»
£Ø3£©·“ӦȯĘ÷µÄČŻ»ż¼õÉŁŅ»°ė£¬Ń¹ĒæŌö“ó£¬øł¾Ż·“Ó¦Ē°ŗóĘųĢåĢå»ż“óŠ”ÅŠ¶Ļ»ÆŃ§Ę½ŗāŅĘ¶Æ·½Ļņ£»
£Ø4£©ŌŚŗćĪĀŗćŃ¹Ģõ¼žĻĀ£¬ĻņĢåĻµÖŠĶØČėÄŹĘų£¬Ģå»żŌö“ó£¬Ń¹Ēæ¼õŠ”£¬Ę½ŗāĻėĒėĖūĢå»żŌö“óµÄ·½Ļņ½ųŠŠ£»
½ā“š ½ā£ŗ£Ø1£©ĖęĪĀ¶ČµÄÉżøߣ¬»ģŗĻĘųĢåµÄŃÕÉ«±äÉī£¬»ÆŃ§Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬¼“”÷H£¾0£»0”«60sŹ±¶Ī£¬N2O4ÅØ¶Č±ä»ÆĪŖ£ŗ0.1mol/L-0.04mol/L=0.06mol/L£¬v£ØN2O4£©=$\frac{0.06mol/L}{60s}$=0.001mol•L-1•s-1£»K=$\frac{{c}^{2}£ØN{O}_{2}£©}{c£Ø{N}_{2}{O}_{4}£©}$=$\frac{£Ø0.12mol/L£©^{2}}{0.04mol/L}$=0.36mol/L£¬
¹Ź“š°øĪŖ£ŗ“óÓŚ”¢0.001mol•L-1•s-1”¢0.36mol/L£»
£Ø2£©¢ŁN2O4µÄÅØ¶Č½µµĶ£¬Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬ÓÉÓŚÕż·“Ó¦·½ĻņĪüČČ£¬T£¾100”ę£¬¹Ź“š°øĪŖ£ŗ“óÓŚ”¢Õż·“Ó¦·½ĻņĪüČČ£¬·“Ó¦ĻņĪüČČ·½ĻņŅĘ¶Æ£¬¹ŹĪĀ¶ČÉżøߣ»
¢ŚĘ½ŗāŹ±£¬c£ØNO2£©=0.120mol•L-1+0.002mol•L-1•s-1”Į10s”Į2=0.16mol•L-1£¬c£ØN2O4£©=0.04mol•L-1-0.002mol•L-1•s-1”Į10s=0.020mol•L-1£¬K2=$\frac{£Ø0.16mol/L£©^{2}}{0.02mol/L}$=1.28mol/L£¬
¹Ź“š°øĪŖ£ŗ1.28mol/L£»
£Ø3£©·“ӦȯĘ÷µÄČŻ»ż¼õÉŁŅ»°ė£¬Ń¹ĒæŌö“ó£¬Õż·“Ó¦·½ĻņĘųĢåĢå»żŌö“ó£¬Ōö“óŃ¹ĒæĻņ×ÅĘųĢåĢå»ż¼õŠ”µÄ·½ĻņŅĘ¶Æ£¬
¹Ź“š°øĪŖ£ŗÄę·“Ó¦”¢¶ŌĘųĢåĢå»żŌö“óµÄ·“Ó¦£¬Ōö“óŃ¹ĒæĘ½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£»
£Ø4£©ŌŚŗćĪĀŗćŃ¹Ģõ¼žĻĀ£¬ĻņĢåĻµÖŠĶØČėÄŹĘų£¬Ģå»żŌö“ó£¬Ń¹Ēæ¼õŠ”£¬øĆ·“Ó¦µÄĖŁĀŹ½«¼õŠ”£¬Ę½ŗāĻņĘųĢåĢå»żŌö“óµÄ·ÖĪö½ųŠŠ£¬Ę½ŗāÕżĻņ½ųŠŠ£¬¹Ź“š°øĪŖ£ŗ±äĀż£»Õż·“Ó¦£»
µćĘĄ ±¾Ģāæ¼²é»ÆŃ§Ę½ŗāĶ¼Ļó”¢Ó°ĻģĘ½ŗāµÄŅņĖŲ”¢Ę½ŗā³£ŹżÓ°ĻģŅņĖŲ”¢»Æѧ·“Ó¦ĖŁĀŹµÄ¼ĘĖćµČ£¬ĢāÄæÄŃ¶Č²»“ó£®


 ŗ®¼Ł“ó“®ĮŖ»ĘɽŹéÉēĻµĮŠ“š°ø
ŗ®¼Ł“ó“®ĮŖ»ĘɽŹéÉēĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Na+ | B£® | Mg2+ | C£® | HCl | D£® | HF |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
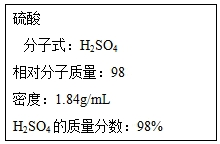 øł¾ŻŅŖĒó»Ų“šĻĀĮŠĪŹĢā£ŗ
øł¾ŻŅŖĒó»Ų“šĻĀĮŠĪŹĢā£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
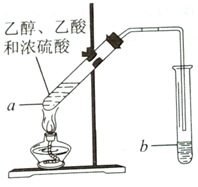 ŗģĘĻĢŃ¾ĘĆÜ·ā“¢“ꏱ¼äŌ½³¤£¬ÖŹĮæŌ½ŗĆ£¬ŌŅņÖ®Ņ»ŹĒ“¢“ę¹ż³ĢÖŠÉś³ÉĮĖĻćĪ¶µÄõ„£®ŌŚŹµŃéŹŅæÉŅŌÓĆČēĶ¼ĖłŹ¾µÄ×°ÖĆÖĘČ”ŅŅĖįŅŅõ„£¬Ēė»Ų“šĻĀĮŠĪŹĢā£®
ŗģĘĻĢŃ¾ĘĆÜ·ā“¢“ꏱ¼äŌ½³¤£¬ÖŹĮæŌ½ŗĆ£¬ŌŅņÖ®Ņ»ŹĒ“¢“ę¹ż³ĢÖŠÉś³ÉĮĖĻćĪ¶µÄõ„£®ŌŚŹµŃéŹŅæÉŅŌÓĆČēĶ¼ĖłŹ¾µÄ×°ÖĆÖĘČ”ŅŅĖįŅŅõ„£¬Ēė»Ų“šĻĀĮŠĪŹĢā£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | “Ė³ĮµķŹĒMg£ØOH£©2”¢Ca£ØOH£©2µÄ»ģŗĻĪļ | |
| B£® | “Ė³ĮµķÖ»ÓŠMg£ØOH£©2 | |
| C£® | ¹żĀĖŗóĀĖŅŗÖŠ“ęŌŚCa2+”¢Mg2+ | |
| D£® | ĻņŌČÜŅŗÖŠ¼ÓČė8.8 g NaOH¹ĢĢ壬²»æÉŅŌŹ¹Ca2+²æ·Ö×Ŗ»ÆĪŖ³Įµķ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ś¢Ū | B£® | ¢Ł¢Ū¢Ü | C£® | ¢Ł¢Ś | D£® | ¢Ś¢Ū¢Ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
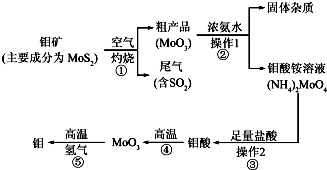
| »ÆѧŹ½ | µēĄė³£Źż |
| H2SO3 | K1=1.3”Į10-2£¬K2=6.2”Į10-8 |
| H2CO3 | K1=4.3”Į10-7£¬K2=5.6”Į10-11 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com