
| A. | 原子半径:A>B>C>D | |
| B. | 元素金属性:B>A,元素非金属性:D>C | |
| C. | 离子半径:D(n+1)->Cn->B(n+1)+>An+ | |
| D. | 原子序数:b>a>c>d |
分析 aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,则有:a-n=b-(n+1)=c+n=d+(n+1),原子序数:b>a>c>d,A、B同周期,C、D同周期,且A、B在周期表中C、D的下一周期,由形成的离子可知,A、B为金属,C、D为非金属性,结合元素周期律递变规律解答该题.
解答 解:aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,则有:a-n=b-(n+1)=c+n=d+(n+1),原子序数:b>a>c>d,A、B同周期,C、D同周期,且A、B在周期表中C、D的下一周期,由形成的离子可知,A、B为金属,C、D为非金属性,
A.A、B在周期表中C、D的下一周期,并且原子序数:b>a>c>d,原子核外电子层数越多,原子半径越大,同周期元素原子序数越大,原子半径越小,则有原子半径:A>B>D>C,故A错误;
B.A、B在周期表中同周期,原子序数:b>a,金属性:A>B,C、D在周期表同周期,原子序数c>d,非金属性C>D,故B错误;
C.aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,核电荷数越大离子半径越小,核电荷数b>a>c>d,故离子半径dD(n+1)->cCn->aAn+>bB(n+1),故C错误;
D.aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,则有:a-n=b-(n+1)=c+n=d+(n+1),则有原子序数:b>a>c>d,故D正确,
故选D.
点评 本题考查位置结构性质关系及应用,根据核外电子排布确定元素所在周期表中的位置以及把握元素周期律的递变规律是解答该题的关键,难度不大.


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲苯与硝酸发生取代反应生成三硝基甲苯 | |
| B. | 甲苯能使热的KMnO4酸性溶液褪色 | |
| C. | 甲苯燃烧时产生带浓烈黑烟的火焰 | |
| D. | 1 mol甲苯最多能与3 mol氢气发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
 3×10-8mol•L-1)
3×10-8mol•L-1)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
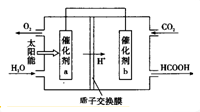
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 事实 | 推测 | |
| A | ${\;}_{12}^{\;}$Mg与水反应缓慢,${\;}_{20}^{\;}$Ca与水反应较快 | ${\;}_{56}^{\;}$Ba(DA族)与水反应会更快 |
| B | 是半导体材料,同族的Ge也是半导体材料 | Ⅳ族的元素都是半导体材料 |
| C | HCl在1500℃时分解,HI在230℃时分解 | HBr的分解温度介于二者之间 |
| D | Si与H2高温时反应,S与H2加热能反应 | P与H2在高温时能反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液 | B. | H2SO4溶液 | C. | NaHCO3溶液 | D. | Ba(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 )作动力源.已知1g液态肼和足量的液态过氧化氢(结构式为H-O-O-H)反应生成N2和水蒸气时放出20.05kJ热量,化学方程式如下:N2H4+2H2O2═N2↑+4H2O.下列说法中错误的是( )
)作动力源.已知1g液态肼和足量的液态过氧化氢(结构式为H-O-O-H)反应生成N2和水蒸气时放出20.05kJ热量,化学方程式如下:N2H4+2H2O2═N2↑+4H2O.下列说法中错误的是( )| A. | 该动力源的突出优点之一是反应产物对环境无污染 | |
| B. | 液态肼燃烧生成1 mol N2时放出的热量为20.05 kJ | |
| C. | 该反应中肼作氧化剂 | |
| D. | 肼和过氧化氢中的化学键类型相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com