
【题目】下列实验操作能达到实验目的的是( )
选项 | 操作 | 目的 |
A | 用酚酞作指示剂,用标准的c mol·L-1盐酸滴定一定体积未知浓度的 | 测定 |
B | 将一定量 | 配制一定物质的量浓度的 |
C | 给含碎瓷片的石蜡油加强热,并将气体通入酸性高锰酸钾溶液中 | 证明气体产物含碳碳双键 |
D | 在 | 证明 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】电解质溶液电导率越大导电能力越强。常温下用0.100mol·L-1盐酸分别滴定10.00mL浓度均为0.100mol·L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温Kb[(CH3)2NH·H2O]=1.6×10-4。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是( )
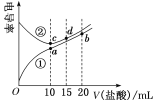
A.曲线②代表滴定二甲胺溶液的曲线
B.a点溶液中:c(H+)=c(OH-)+c[(CH3)2NH·H2O]
C.d点溶液中:2c(Na+)=3c(Cl-)
D.在相同温度下,a、b、c、d四点的溶液中,水的电离程度最大的是c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 向水中通入氯气:Cl2+H2O===2H+ + ClO+ Cl
B. 向Ca(HCO3)2溶液中滴加足量NaOH溶液:Ca2+ + 2HCO3+2OH===CaCO3↓+CO32+2H2O
C. 向明矾溶液中加过量氨水:Al3++4NH3·H2O===AlO2+4NH4++2H2O
D. 将Fe2O3溶解与足量HI溶液:Fe2O3+6H+===2Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以冶铝的废弃物铝灰为原料制取超细α氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
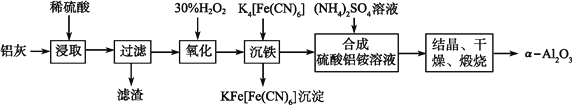
(1)写出铝灰与硫酸反应涉及的离子方程式_____________。
(2)图中“滤渣”的主要成分为________(填化学式)。
(3)加30%H2O2溶液发生的离子反应方程式为_________________________________。
(4)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2·12H2O]![]() 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置。
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置。
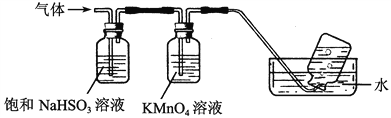
①集气瓶中收集到的气体是________(填化学式)。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有________(填化学式)。
③KMnO4溶液褪色(MnO被还原为Mn2+),发生的离子反应方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某苯的衍生物,含有两个互为对位的取代基,其分子式为C8H10O,其中不溶解于NaOH溶液的该衍生物的结构式有( )
A.1种B.2种C.3种D.4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿斯巴甜作为强烈甜味剂被广泛应用于食品、饮料、糖果等,工业上可以用苯丙氨酸甲酯和α﹣氨基丁二酸为原料合成:
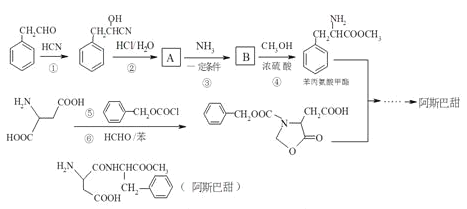
已知:RCN![]() RCOOH;
RCOOH;![]()
![]()
![]()
(1)A中含氧官能团的名称为____________________________;
(2)①、⑤的反应类型依次为_______________、_______________;
(3)B的同分异构体中同时符合下列条件的有2种,写出其结构简式为_____________;
①有三种化学环境不同的氢原子;②含苯环的中性物质
(4)写出阿斯巴甜与足量NaOH水溶液充分反应的化学方程式_____________;
(5)写出以1,3﹣丙二醇(HOCH2﹣CH2﹣CH2OH)为原料制备  的合成路线流程(无机试剂任选).合成路线流程示例如下:CH2═CH3
的合成路线流程(无机试剂任选).合成路线流程示例如下:CH2═CH3 ![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH:____________________________________ 。
CH3CH2OH:____________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 n![]() 是阿伏加德罗常数的数值,下列说法正确的是
是阿伏加德罗常数的数值,下列说法正确的是
A.常温常压下,![]() 克 HCl溶于水后溶液中含有 N
克 HCl溶于水后溶液中含有 N![]() 个HCl分子
个HCl分子![]()
B.标准状况下,![]() 和
和![]() 混合气体含有 N
混合气体含有 N![]() 个氧原子
个氧原子
C.![]() 的
的![]() 溶液中含有阴离子大于
溶液中含有阴离子大于![]() N
N![]() 个
个
D.![]() 与足量Fe反应,转移的电子数为3 N
与足量Fe反应,转移的电子数为3 N![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标况下,1.92g某气体的体积为672mL,则该气体的摩尔质量为__________。
(2)2L Fe2(SO4)3溶液中含Fe3+22.4g,则溶液中Fe3+的物质的量浓度为____________。
(3)现有4.4g CO2气体,在标准状况下其体积为___________,氧原子的个数为___________(用NA表示阿伏加德罗常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2-溴乙烷的反应原理如下:CH3CH2OH![]() CH2=CH2+H2O CH2=CH2+Br2
CH2=CH2+H2O CH2=CH2+Br2![]() BrCH2CH2Br可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
BrCH2CH2Br可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
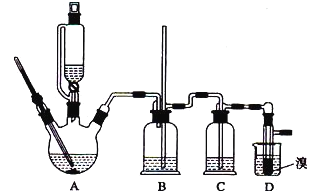
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度(g/cm3) | 0.79 | 2.2 | 0.71 |
沸点(℃) | 78.5 | 132 | 34.6 |
熔点(℃) | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是______(填正确选项前的字母)。
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)装置B的作用是______。
(3)在装置c中应加入____(填正确选项前的字母),其目的是吸收反应中可能生成的酸性气体。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)判断该制备反应己经结束的最简单方法是_______。
(5)将1, 2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在____层(填“上”、“下”)。
(6)若产物中有少量未反应的Br2,最好用______(填正确选项前的字母)洗涤除去。
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(7)若产物中有少量副产物乙醚,可用________的方法除去。
(8)反应过程中应用冷水冷却装置D,其主要目的是_________;但又不过度冷却(如用冰水),其原因是______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com