
【题目】(1)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。(As为砷元素)
①已知KBrO3在反应中得到电子,则该反应的还原剂是____________________
②已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为_____________
③根据上述反应可推知_______
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4> KBrO3
c.还原性:AsH3>X d.还原性:X > AsH3
(2)①向MnSO4和硫酸的混合溶液里加入K2S2O8(过二硫酸钾),溶液会发如下反应:Mn2++S2O82-+H2O→MnO4-+SO42-+H+,该反应常用于检验Mn2+的存在。其特征现象是_________________,若反应中有0.1 mol还原剂参加反应,则消耗氧化剂的物质的量为__________
②将NaBiO3固体(黄色微溶)加入到MnSO4和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应:NaBiO3+MnSO4+H2SO4→Na2SO4+Bi2(SO4)3+NaMnO4+H2O,配平上述反应的化学方程式,并用双线桥标出电子转移的方向和数目__________;
【答案】AsH3 Br2 ac 溶液由无色变为紫色 0.25mol 
【解析】
(1)①KBrO3在反应中得到电子,所以KBrO3是氧化剂,AsH3变成了H3AsO4,As元素化合价升高,所以AsH3是还原剂,
故答案为:AsH3;
②设X中溴元素的化合价为a,则0.2mol×(5a)=1mol,所以a=0,故X为Br2,
故答案为:Br2;
③在反应中,氧化剂为KBrO3,还原剂为AsH3,氧化产物为H3AsO4,还原产物为Br2,由氧化剂的氧化性大于氧化产物的氧化性可知,氧化性:KBrO3>H3AsO4,由还原剂的还原性大于还原产物的还原性可知,还原性:AsH3>X(Br2),
故答案为:ac;
(2)①由反应可知生成MnO4-,溶液由无色变为紫色;Mn元素化合价由+2价升高为+7价,升高5价,S元素化合价由+7价降低为+6价,2个S共降低2价,故0.1mol还原剂参加反应,消耗氧化剂的物质的量为0.1×5÷2=0.25mol,
故答案为:溶液由无色变为紫色,0.25mol;
②反应中NaBiO3→Bi2(SO4)3,Bi元素化合价由+5价降低为+3价,每生成1个Bi2(SO4)3共降低4价,MnSO4→NaMnO4,Mn元素化合价由+2价升高为+7价,共升高5价,化合价升降最小公倍数为20,故Bi2(SO4)3系数为5,MnSO4系数为4,根据元素守恒可知,NaBiO3的系数为10,NaMnO4系数为4,根据钠元素守恒可知Na2SO4的系数为3,根据硫酸根守恒可知H2SO4的系数为14,根据氢元素守恒可知H2O的系数为14,配平反应的化学方程式,标出电子转移的方向和数目为: ,
,
故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】下列反应中,氧化剂与还原剂物质的量的关系为1∶2的是( )
A.Fe+2HCl=FeCl2+H2↑B.4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
C.I2+2NaClO3=2NaIO3+Cl2↑D.2HCl+Ca(ClO)2=2HClO+CaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列装置,叙述不正确的是

A.石墨电极反应式: O2+4H++4e-=2H2O
B.温度计的示数会上升
C.加入少量NaCl ,会加快 Fe 生锈
D.加入 HCl,石墨电极反应式: 2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况。试判断,违反了泡利原理的是___________,违反了洪特规则的是____________。
①![]() ②
②![]() ③
③![]() ④
④![]() ⑤
⑤![]()
(2)用符号“>”“<”或“=”表示下列各项关系。
①第一电离能:Na____Mg,Mg_____Ca。
②电负性:O______F,F______Cl。
③能量高低:ns______(n+1)s,ns______np。
④主族序数______价电子数______元素最高正化合价。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,氧化剂与还原剂物质的量的关系不是1∶2的是
A.O3+2KI+H2O===2KOH+I2+O2
B.3NO2+H2O===2HNO3+NO
C.3S+6NaOH===Na2SO3+2Na2S+3H2O
D.4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国最近在太阳能光电催化-化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。下列说法正确的是
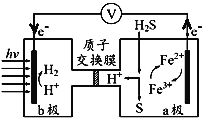
A.该装置工作时,H+由b极区流向a极区
B.该制氢工艺中光能最终转化为化学能
C.a极上发生的电极反应为Fe3++e-=Fe2+
D.a极区需不断补充含Fe3+和Fe2+的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C的原子序数依次增大,它们的原子最外层电子数之和为10,A与C同主族,B原子的最外层电子数等于A原子的次外层电子数,则下列叙述正确的是( )
A.原子半径:A<B<C
B.三种元素的最高价氧化物对应水化物均可由化合反应得到
C.A的氢化物稳定性小于C的氢化物稳定性
D.B 和A的最高价氧化物可发生置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,CH4和CO燃烧的热化学方程式分别为:
CH4(g)+2O2(g)![]() 2H2O(l)+CO2(g) ΔH =﹣890 kJ/mol
2H2O(l)+CO2(g) ΔH =﹣890 kJ/mol
2CO(g)+O2(g)![]() 2CO2(g) ΔH =﹣566 kJ/mol
2CO2(g) ΔH =﹣566 kJ/mol
如果有CH4和CO的混合气体充分燃烧,放出的热量为262.9 kJ,生成的CO2用过量的饱和石灰水完全吸收,得到50g白色沉淀。则混合气体中CH4和CO的体积比为( )
A.1∶2B.1∶3C.2∶3D.3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某化合物M(仅含三种短周期元素)是一种储氢材料。为探究M的组成和性质,设计并完成如下实验:
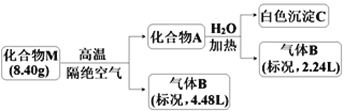
已知:化合物A仅含两种元素;气体B能使湿润的红色石蕊试纸变蓝。
请回答:(1)化合物M的组成元素是______________(用元素符号表示)。
(2)化合物A与水反应的化学方程式是______________________。
(3)镁带在足量气体B中燃烧可生成化合物M和一种单质气体,该反应的化学方程式是______。
II.无机盐X仅由三种短周期元素组成,其相对分子质量为238,原子个数比为1︰1︰4。将23.8gX与水共热,生成一种有特殊臭味的气体单质A和某强酸的酸式盐溶液B,B的焰色反应呈黄色,在溶液B中加入足量的BaCl2溶液,产生46.6g白色沉淀。请推测并回答:
(4)单质A有很强的氧化性,可用于净化空气,饮用水消毒等。A中组成元素的简单离子结构示意图为___________________________。
(5)X的化学式_____________。
(6)实验室可通过低温电解B溶液制备X。该电解反应的化学方程式___________________。
(7)X氧化能力强,对环境友好,可用于脱硝、脱硫。在碱性条件下,X氧化NO的离子方程式_____________________。
(8)X溶液与铜反应时先慢后快。某同学认为除反应放热这一因素外,还有一种可能是反应生成的Cu2+对后续反应起催化作用,为此他设计了如下实验方案:取少量铜粉置于试管中,先加入少量CuSO4溶液,再加入X溶液,振荡,观察现象。若加入硫酸铜溶液的反应快,说明Cu2+起了催化作用,反之Cu2+不起作用。写出X与铜反应的化学方程式________,判断该同学设计的验证方法合理性并说明理由_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com