
| 酸 | HX | HY | HZ |
| 电常数 | 9×10-7 | 9×10-6 | 10-2 |
| A、三种酸的强弱关系:HX>HY>HZ |
| B、反应 HZ+Y-═HY+Z-够发生 |
| C、相同温度下,0.1 mol?L-1的NaX、NaY、NaZ溶液,NaZ溶液pH最大 |
| D、相同温度下,1 mol?L-1HX溶液的电离常数大于0.1 mol?L-1HX |


科目:高中化学 来源: 题型:
| A、向0.1 mol?L-1氯化铁溶液中加入少量的KOH溶液制取氢氧化铁胶体 |
| B、由0.1mol氯化铁制取的氢氧化铁胶体中,氢氧化铁胶粒数目小于0.1NA(设NA表示阿伏加德罗常数的值) |
| C、氢氧化铁胶体通电后氢氧化铁胶粒向正极移动 |
| D、可以用布朗运动区别硫酸铜溶液和氢氧化铁胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
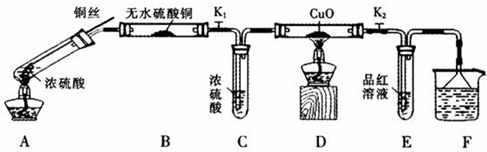
| 硫酸/mol?L-1 | 黑色物质出现的温度/℃ | 黑色物质消失的温度/℃ |
| 15 | 约150 | 约236 |
| 16 | 约150 | 约250 |
| 18 | 约120 | 不消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子半径:X<Y<Z<W |
| B、Z与W两种元素形成的最简单化合物是平面三角形,为非极性分子 |
| C、由X、Y、Z三种元素形成的化合物,既可以是离子化合物,又可以是共价化合物 |
| D、X2Z的熔点比X2W高,是因为X2Z分子内存在氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,常温常压下气体X(见选项)与O2等物质的量混合后充满圆底烧瓶,挤压胶头滴管并打开止水夹,可观察到烧杯中的水沿导管进入烧瓶.长时间充分反应后,烧瓶中所得溶液的物质的量浓度最小的是(假设溶质不向烧瓶外扩散)( )
如图所示,常温常压下气体X(见选项)与O2等物质的量混合后充满圆底烧瓶,挤压胶头滴管并打开止水夹,可观察到烧杯中的水沿导管进入烧瓶.长时间充分反应后,烧瓶中所得溶液的物质的量浓度最小的是(假设溶质不向烧瓶外扩散)( )| A、NH3 |
| B、HCl |
| C、SO2 |
| D、NO2(假设不含N2O4) |
查看答案和解析>>
科目:高中化学 来源: 题型:
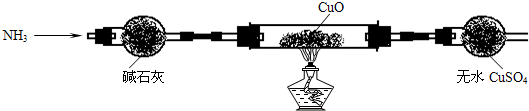
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com