
分析 根据n=cV计算NaOH的物质的量,根据关系式为S~SO2~H2SO4~2NaOH计算S原子物质的量,再计算Fe原子的物质的量,进而确定化学式.
解答 解:n(NaOH)=0.02L×1mol/L=0.02mol,
由反应的关系式:S~SO2~H2SO4~2NaOH可知,n(S)=$\frac{1}{2}$n(NaOH)=0.02mol×$\frac{1}{2}$=0.01mol,
则硫和铁组成的化合物中m(S)=0.01mol×32g/mol=0.32g,则Fe的质量为0.6g-0.32g=0.28g,
则n(Fe)=$\frac{0.28g}{56g/mol}$=0.005mol,所以n(Fe):n(S)=0.005:0.01=1:2,即铁的硫化物的化学式为FeS2;
答:该化合物的化学式为FeS2.
点评 本题考查化学方程式有关计算,涉及多步反应的计算,注意利用关系式的进行解答,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:解答题
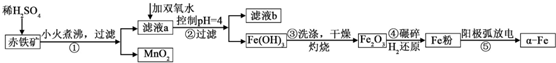
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
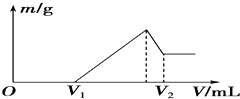 0.1mol的镁、铝混合物溶于100mL 2mol•L-1H2SO4溶液中,然后再滴加1mol•L-1NaOH溶液.请回答:
0.1mol的镁、铝混合物溶于100mL 2mol•L-1H2SO4溶液中,然后再滴加1mol•L-1NaOH溶液.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
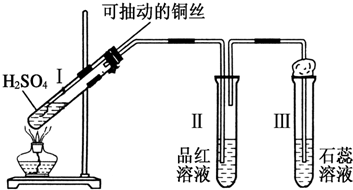
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24L或4.48L | B. | 2.24L或6.72L | C. | 4.48L或8.96L | D. | 6.72L或8.96L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在“镀锌铁皮厚度测量”实验中,当锌在酸中完全溶解后,产生氢气的速率会显著减慢,可借此判断镀锌铁皮中锌镀层是否完全反应 | |
| B. | 做“食醋总酸含量的测定”实验时,必须先将市售食醋稀释10倍,然后用洗净的酸式滴定管量取一定体积的稀释液于洁净的锥形瓶中,锥形瓶不需要先用醋酸溶液润洗 | |
| C. | 铁钉镀锌前,先要用砂纸打磨直至表面变得光滑,然后放入45℃的浓盐酸中浸泡2min,再取出用水洗净 | |
| D. | 在两支试管中分别加1ml无水乙醇和1.5g苯酚固体,再各加一小块(绿豆大小)吸干煤油的金属钠,比较乙醇、苯酚羟基上氢原子的活泼性 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
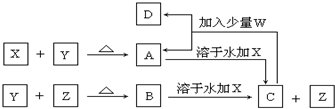
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两极材料都用金属铂,用一定浓度的盐酸做电解质溶液 | |
| B. | 通入氯气的电极为原电池的正极 | |
| C. | 该方法可将化学能完全转化为电能 | |
| D. | 通氢气的电极发生的反应为:H2→2H++2e- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com