
| T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| [N2O4] |
| [NO2]2 |
| 3 |
| 2 |
| 1 |
| 2 |
| [N2O4] |
| [NO2]2 |
| 0.125mol/L |
| 0.50mol/L2 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、两者颜色不一样 |
| B、两者外观上都不透明 |
| C、两者都能产生丁达尔现象 |
| D、两者不能产生丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HA能与水以任意比互溶 |
| B、0.1mol?L-1HA溶液的pH约为3 |
| C、HA可与NaHCO3反应放出CO2 |
| D、HA溶液的导电能力很差 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
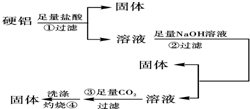 硬铝中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如图所示实验:
硬铝中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如图所示实验:查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol?L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,其分子式为
,其分子式为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com