
 我国科研人员研制出一种室温“可呼吸”Na-CO2电池.放电时该电池“吸入”CO2,充电时“呼出”CO2.吸入CO2时,其工作原理如图所示.吸收的全部CO2中,有$\frac{2}{3}$转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面.下列说法不正确的是( )
我国科研人员研制出一种室温“可呼吸”Na-CO2电池.放电时该电池“吸入”CO2,充电时“呼出”CO2.吸入CO2时,其工作原理如图所示.吸收的全部CO2中,有$\frac{2}{3}$转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面.下列说法不正确的是( )| A. | 每“呼出”22.4LCO2,转移电子数为$\frac{4}{3}$mol | |
| B. | “吸入”CO2时的正极反应:4Na++3CO2+4e-=2Na2CO3+C | |
| C. | “呼出”CO2时钠箔电极反应式是Na++e-=Na | |
| D. | 放电时电池总反应是4Na+3CO2=2Na2CO3+C |
分析 A、未指明标准状况无法计算;
B、“吸入”CO2时是原电池装置,正极发生还原反应,电极反应式为:4Na++3CO2+4e-═2Na2CO3+C;
C、“呼出”CO2时,是电解池,阴极钠箔得电子发生还原反应;
D、放电时电池总反应即钠与二氧化碳反应生成碳酸钠和碳;
解答 解:A、未指明标准状况无法计算,故A错误;
B、“吸入”CO2时是原电池装置,正极发生还原反应,电极反应式为:4Na++3CO2+4e-═2Na2CO3+C,故B正确;
C、“呼出”CO2时,是电解池,阴极钠箔得电子发生还原反应,反应式是Na++e-=Na,故C正确;
D、放电时电池总反应即钠与二氧化碳反应生成碳酸钠和碳,总反应是4Na+3CO2=2Na2CO3+C,故D正确;
故选A.
点评 本题考查电化学的相关知识、电极反应式的书写等知识点,注意电极反应式的书写,为易错点题目难度中等.


 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:K>Cl>Na | B. | 热稳定性:HF>H2O>PH3 | ||
| C. | 酸性强弱:HClO4>H2SO4>H3PO4 | D. | 碱性强弱:KOH>NaOH>Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不能与氧气反应 | B. | 储存巨大能量 | ||
| C. | 是氢的一种同素异形体 | D. | 内部存在自由移动的电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 75.77%表示35Cl的质量分数 | |
| B. | 24.23%表示35Cl在自然界所占的原子个数百分比 | |
| C. | 35.453表示氯元素的相对原子质量 | |
| D. | 36.966表示37Cl的质量数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
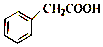 环扁桃酸酯是治疗心脑血管疾病的有效药物.苯乙酸是合成环扁桃酸酯的重要中间体,其结构简式如图,下列关于苯乙酸的说法错误的是( )
环扁桃酸酯是治疗心脑血管疾病的有效药物.苯乙酸是合成环扁桃酸酯的重要中间体,其结构简式如图,下列关于苯乙酸的说法错误的是( )| A. | 与苯甲酸互为同系物 | |
| B. | 有6种含酯基的芳香化合物与其互为同分异构体 | |
| C. | 能发生取代反应和加成反应 | |
| D. | 与CH3CH2OH所生成酯的分子式为C10H14O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z的简单气态氢化物的热稳定性比Y的强 | |
| B. | 原子半径:r(W)>r(Q)>r(Z)>r(X) | |
| C. | 由X、Y、Z三种元素组成的化合物可以是酸、碱或盐 | |
| D. | Q的最高于氧化物对应的水化物可以溶于浓的YX4W溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀NaOH溶液中通入Cl2:Cl2+2OH-═ClO-+Cl-+H2O | |
| B. | 向Fe2(SO4)3溶液中加入铜粉:2Fe3++3Cu═2Fe+3Cu2+ | |
| C. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| D. | 向氨水中通入过量SO2:SO2+OH-═HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酒精灯外焰加热铝箔,铝箔熔化但不滴落,说明Al2O3的熔点比Al的熔点高 | |
| B. | 锅炉水垢CaSO4可用Na2CO3溶液浸泡,再用酸溶解去除,说明Ksp:CaCO3>CaSO4 | |
| C. | 用酸性KMnO4溶液验证草酸的还原性 | |
| D. | 向滴有KSCN的FeCl3溶液中加入NaOH溶液以研究反应物浓度对化学平衡的影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com