
下表是不同温度下水的离子积的数据:
|
温度/℃ |
25 |
t1 |
t2 |
|
水的离子积 |
1×10-14 |
a |
1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a________1×10-14(填“>”、“<”或“=”),做此判断的理由是____________________________________________________________.
(2)25℃时,某Na2SO4溶液中c(SO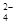 )=5×10-4
mol/L,取该溶液1 mL加水稀释至10 mL,
)=5×10-4
mol/L,取该溶液1 mL加水稀释至10 mL,
则稀释后溶液中c(Na+)∶c(OH-)=________.
(3)在t2温度下测得某溶液pH=7,该溶液显______(填“酸”、“碱”或“中”)性.将此温度下pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合.
①若所得混合液为中性,则a∶b=________.
②若所得混合液pH=2,则a∶b=________.
(12分)(1)>(1分) 温度升高,水的电离程度增大,离子积增大
(2)1000∶1 (3)碱 ①1∶1 ②9∶11
【解析】
试题分析:(1)水的电离是吸热的,所以温度升高,水的电离程度增大,离子积增大。
(2)25℃时,某Na2SO4溶液中c(SO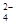 )=5×10-4
mol/L,则溶液中钠离子浓度是1×10-3 mol/L。如果稀释10倍,则钠离子浓度是1×10-4
mol/L.但硫酸钠溶液是显中性的,所以c(Na+)∶c(OH-)=10-4︰10-7=1000∶1.
)=5×10-4
mol/L,则溶液中钠离子浓度是1×10-3 mol/L。如果稀释10倍,则钠离子浓度是1×10-4
mol/L.但硫酸钠溶液是显中性的,所以c(Na+)∶c(OH-)=10-4︰10-7=1000∶1.
(3)t2温度下水的离子积常数是1×10-12,所以在该温度下,pH=6是显中性的。因此某溶液pH=7,该溶液显碱性;此温度下pH=11的NaOH溶液中OH-的浓度是0.1mol/L,则
①若所得混合液为中性,由于硫酸中氢离子的浓度也是0.1mol/L,则a∶b=1∶1。
②若所得混合液pH=2,说明酸过量,所以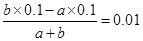 ,解得a∶b=9∶11。
,解得a∶b=9∶11。
考点:考查水的电离、水的离子积常数和pH的有关计算
点评:该题是基础上试题的考查,难度不大。但该题在进行pH计算时,需要特别注意的是水的离子积常数是受温度变化影响的,所以如果溶液的温度不是常温时,不能在一味用1×10-14,否则会得出错误的结论。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积 | 1×10-14 | a | 1×10-12 |
| SO | 2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度(℃) | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-13 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 25 | t1 | t2 |
| Kw/mol2?L-2 | 1×10-14 | a | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | KW | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | KW | 1×10-12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com