
| A. | Na+ | B. | Cl- | C. | HCO3- | D. | Fe2+ |
分析 根据稳定人体血液的pH可知,则选项中的离子既能与酸反应又能与碱反应才符合题意,以此来解答.
解答 解:A.Na+不水解,为强碱阳离子,则不能起到调节人体内pH值的作用,故A错误;
B.Cl-不水解,为强酸阴离子,则不能起到调节人体内pH值的作用,故B错误;
C.HCO3-在溶液中存在两个趋势:HCO3-离子电离使得溶液呈酸性,或者HCO3-水解呈现碱性,即电离呈酸性,降低pH值,水解呈碱性,pH值升高,故C正确;
D.Fe2+水解,为弱碱阳离子,使得溶液水解呈酸性,只能降低pH值,故D错误;
故选C.
点评 本题属于容易题,明确稳定pH是解答本题的关键,并熟悉盐类水解的规律及常见离子的水解及酸式酸根离子的性质来解答.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年江苏省高二上10月阶段测化学卷(解析版) 题型:填空题
化合物A[KxFe(C2O4)y·zH2O,其中铁元素为+3价]是一种重要的光化学试剂。
(1)制备化合物A的实验流程如下:
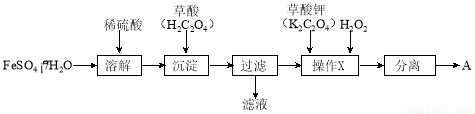
① 上述流程中,检验“过滤”后的固体已洗涤干净的方法是 。
② 上述流程“操作X”中加入H2O2的目的是  。
。
(2)测定化合物A的化学式实验步骤如下:
a、准确称取A样品4.91g,干燥脱水至恒重,残留物质的质量为4.37g;
b、将步骤a所得固体溶于水,加入还原铁粉0.28g,恰好完全反应;
c、另取A样品4.91g置于锥形瓶中,加入足量的3 mol/L的H2SO4溶液和适量蒸馏水,再加入0.50mol/L的KMnO4溶液24.0 mL,微热,恰好完全反应:
2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
通过计算填空,请写出解题过程。
① 4.91g A样品中含结晶水的物质的量为 mol。
② A样品中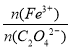 = 。
= 。
③ A的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜的金属活动性比铁的弱,铜不能与任何强酸发生反应 | |
| B. | 浓硫酸可用作干燥剂是因为其具有强氧化性 | |
| C. | 利用Al2O3制作的坩埚,可用于熔融烧碱 | |
| D. | 制水泥和玻璃都用石灰石作原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤ | B. | ②③④⑥⑧ | C. | ①②③④⑤ | D. | ②③④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
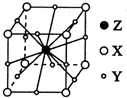 X、Y、Z、W为短周期元素且原子序数依次增大.X的一种气态氢化物m可用来焊接或切割金属,且该分子所有原子在一条直线上.Y2-的M能层的原子轨道为全空状态.Z的单质用作铝热反应的引燃剂,化合物ZW2的晶体为离子晶体. W与X形成的化合物是一种常见的有机溶剂n.A为第四周期元素,其基态原子含有6个未成对电子.
X、Y、Z、W为短周期元素且原子序数依次增大.X的一种气态氢化物m可用来焊接或切割金属,且该分子所有原子在一条直线上.Y2-的M能层的原子轨道为全空状态.Z的单质用作铝热反应的引燃剂,化合物ZW2的晶体为离子晶体. W与X形成的化合物是一种常见的有机溶剂n.A为第四周期元素,其基态原子含有6个未成对电子.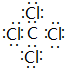
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
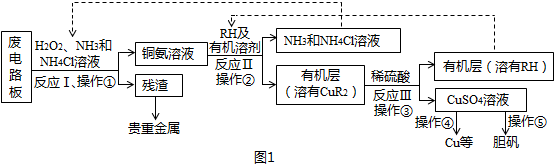
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液:Ag+、Al3+、Cl-、SO42- | |
| B. | 能使酚酞试液变红的溶液:Na+、K+、HCO3-、S2- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=10-12的溶液:NH4+、Cu2+、NO3-、Cl- | |
| D. | 水电离产生的c(OH-)=10-12 mol•L-1的溶液:K+、Fe2+、SO42-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com