
锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )
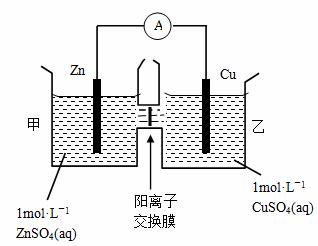
A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的c(SO42-)减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.阴阳离子离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
【答案】C
【解析】由图像可知该原电池反应原理为Zn+ Cu2+= Zn2++ Cu,故Zn电极为负极失电子发生氧化反应,Cu电极为正极得电子发生还原反应,故A项错误;该装置中为阳离子交换膜只允许阳离子和水分子通过,故两池中c(SO42-)不变,故B项错误;电解过程中溶液中Zn2+由甲池通过阳离子交换膜进入乙池,乙池中Cu2++2e—= Cu,故乙池中为Cu2+~Zn2+,摩尔质量M(Zn2+)>M(Cu2+)故乙池溶液的总质量增加,C项正确;该装置中为阳离子交换膜只允许阳离子和水分子通过,电解过程中溶液中Zn2+由甲池通过阳离子交换膜进入乙池保持溶液中电荷平衡,阴离子并不通过交换膜,故D项错误;本题选C。
【考点定位】本题主要考查了原电池的反应原理,涉及反应类型、离子浓度的变化、电极的判断、离子的移动方向的判断等
【名师点睛】电化学反应原理是选修4中的重要内容,也是难点之一。原电池的反应原理的应用,抓住化学反应的本质、正负极的判断、正负极反应类型的判断、电极反应式的书写、总反应方程式的书写、电子的流向、电流的流向、溶液中离子的流向、电极是否参加反应、电子的转移、有关氧化还原反应的计算、溶液质量的变化、离子交换膜的判断、溶液的pH的计算或变化、溶液颜色的变化是解题的关键。综合性较强,针对每个知识点进行详细剖析,使学生真正理解原电池的反应中所涉及的知识。


科目:高中化学 来源: 题型:
被称为“魔棒”的荧光棒已成为节日之夜青少年的喜爱之物,其发光原理是利用过氧化氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)制成的溶液。草酸二酯(CPPO)结构简式如右图。下列有关说法不正确的是( )
A、发光的魔棒不能凑近石油气之类的可燃性气体,否则会导致爆炸
B、如果在发光中途,把它放入冰箱的冷冻室中,发光便会停止或基本停止
C、如果在发光中途,敲打魔棒亮度会增强
D、1mol与氢氧化钠稀溶液反应(苯环上卤素不水解),最多消耗4molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
尼泊金甲酯可在化妆品中作防腐剂,结构简式为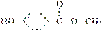 。下列说法中不正确的是( )
。下列说法中不正确的是( )
A.该物质属于芳香烃
B.该物质的分子式为C8H8O3
C.该物质能够和FeCl3溶液反应,使溶液呈紫色
D.在一定条件下,1 mol该物质最多能和2 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子组一定能大量共存的是( )
A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-
B.由水电离出c(H+)=10-3 mol·L-1的溶液中:Na+、AlO2-、NO3-、HCO3-
C.无色溶液中可能大量存在Al3+、NH4+、Cl-、S2-
D.pH=12的溶液:K+、Na+、CH3COO-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
银、铜均属于重金属,从银铜合金废料中回收银并制备含铜化合物产品的工艺如图所示:
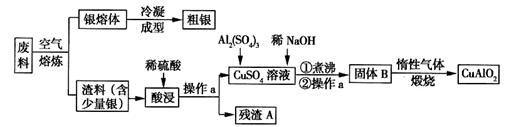
(1)熔炼时被氧化的元素是______,酸浸时反应的离子方程式为_______。为提高酸浸时铜元素的浸出率及浸出速率,酸浸前应对渣料进行处理,其处理方法是_______。
(2)操作a是______,固体B转化为CuAlO2的过程中,存在如下反应,请填写空白处:___CuO+____Al2O3 ______________+________↑。
______________+________↑。
 (3)若残渣A中含有n mol Ag,将该残渣全部与足量的稀HNO3置于某容器中进行反应,写出反应的化学方程式________________________。为彻底消除污染,可将反应中产生的气体与V L(标准状况)空气混合通入水中,则V至少为_______L(设空气中氧气的体积分数为0.2)。
(3)若残渣A中含有n mol Ag,将该残渣全部与足量的稀HNO3置于某容器中进行反应,写出反应的化学方程式________________________。为彻底消除污染,可将反应中产生的气体与V L(标准状况)空气混合通入水中,则V至少为_______L(设空气中氧气的体积分数为0.2)。
(4)已知2Cu+ Cu+Cu2+,试分析CuAlO2分别与足量盐酸、稀硝酸混合后,产生现象的异同点______________________________。
(5)假设粗银中的杂质只有少量的铜,利用电化学方法对其进行精炼,则粗银应与电源的_______极相连,当两个电极上质量变化值相差30.4g时,则两个电极上银质量的变化值相差__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
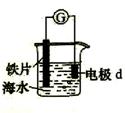
研究电化学腐蚀及防护的装置如右图所示。下列有关说法错误的是( )
A.d为石墨,铁片腐蚀加快
B.d为石墨,石墨上电极反应为:O2 + 2H2O + 4e → 4OH–
 C.d为锌块,铁片不易被腐蚀
C.d为锌块,铁片不易被腐蚀
D.d为锌块,铁片上电极反应为:2H+ + 2e → H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。
(1)原子序数为29的铜元素位于元素周期表中第 周期。
(2)某青铜器中Sn、Pb的质量分别为119g、20.7g,则该青铜器中Sn和Pb原子的数目之比为 。
(3)研究发现,腐蚀严重的青铜器表面大都存在CuCl。关于CuCl在青铜器腐蚀过程中的催化作用,下列叙述正确的是 。
A.降低了反应的活化能 B.增大了反应的速率
C.降低了反应的焓变 D.增大了反应的平衡常数
(4)采用“局部封闭法”可以防止青铜器进一步被腐蚀。如将糊状Ag2O涂在被腐蚀部位,Ag2O与有害组分CuCl发生复分解反应,该化学方程式为 。
(5)题11图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。
①腐蚀过程中,负极是 (填图中字母“a”或“b”或“c”);
②环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈u2(OH)3Cl,其离子方程式为 ;
③若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为 L(标准状况)。

查看答案和解析>>
科目:高中化学 来源: 题型:
下列是除去括号内杂质的有关操作,其中正确的是-------------------------( )
A.苯(苯酚)——加浓溴水,振荡静置分液
B.NO(NO2)——通过水洗、干燥后,用向下排气法收集
C.乙烷(乙烯)——让气体通过盛酸性高锰酸钾溶液的洗气瓶
D.乙醇(乙酸)——加足量NaOH溶液,蒸馏 
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各醇能发生消去反应生成不饱和化合物的是 ----------------------------------------( )
A.CH3OH B.C2H5OH
C .
.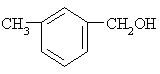 D.
D.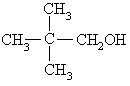
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com