
【题目】氯化铁溶液与氢氧化铁胶体具有的共同性质是
A.分散质粒子直径都在1—100nm之间 B.都能透过半透膜
C.都能通过滤纸 D.都呈红褐色
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3﹣═3Fe3++NO↑+3H2O
B.向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2﹣+CO2+2H2O═Al(OH)3↓+HCO3-
C.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl﹣![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO﹣+2Fe(OH)3═2FeO42﹣+3Cl﹣+H2O+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是 ( )
A.电解氯化镁溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B.氢氧化铁与足量的氢溴酸溶液反应:Fe(OH)3+3H+=Fe3++3H2O
C.氢氧化钡溶液中加入硫酸:Ba2++OH—+H++SO42—=BaSO4↓+H2O
D.鸡蛋壳浸泡在盐酸中产生气泡:CO32—+2H+=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电化学装置的叙述正确的是 ( )
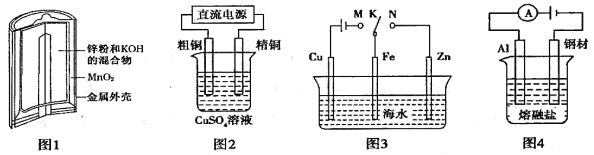
A.图1中,Zn—MnO2干电池放电时,MnO2被氧化
B.图2中,电解精炼铜时,阳极减少的质量与阴极增加的质量一定相等
C.图4中,在钢材上电镀铝,熔融盐中Al和Cl元素只以AlCl4-、Al2Cl7-形式存在,则阳极反应式为:Al -3e-+7AlCl4-=== 4Al2Cl7-
D.图3中,K分别与M、N连接,均可保护Fe电极,连接M时称为“牺牲阳极的阴极保护法”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某同学测定化学反应速率并探究其影响因素的实验。
Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率。
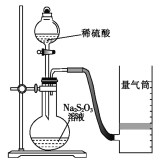
(已知:S2O32-+2H+ = H2O+S↓+SO2↑)
(1)除如图所示的实验用品、仪器外,还需要的一件实验仪器是__________________。
(2)若在2 min时收集到224 mL(已折算成标准状况)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是 。
(3)试简述测定该反应的化学反应速率的其他方法: (写一种)。
Ⅱ.为探讨化学反应速率的影响因素,设计的实验方案如下表。
(已知 I2+2S2O32- = S4O62-+2I-,其中Na2S2O3溶液均足量)
实验序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
(4)该实验进行的目的是 ,淀粉溶液的作用是 ,表中Vx= mL,通过比较t1、t2、t3大小,试推测该实验结论:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B两个完全相同的装置,某学生分别在它们的侧管中装入1.06 g Na2CO3和0.84 g NaHCO3,A、B中分别有10 mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中,下列叙述正确的是
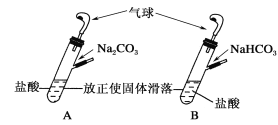
A.A装置的气球膨胀速率大
B.若最终两气球体积相同,则盐酸的浓度一定大于或等于2 mol·L-1
C.若最终两气球体积不同,则盐酸的浓度一定小于或等于1 mol·L-1
D.最终两试管中Na+、Cl-的物质的量一定相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度相同的NaNO3、Mg(NO3)2、Al(NO3)3三种溶液的体积比为3:2:1时,三种溶液中c(NO3-)之比为
A.1:1:1 B.1:2:3 C.3:2:1 D.3:4:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微量元素是指每种质量不到体重的万分之一,质量总和不到人体质量的千分之一的近二十种元素,这些元素对人体正常代谢和健康起着重要作用。下列元素不是微量元素的是( )
A.I B.H C.Zn D.Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,既属于氧化还原反应同时又是吸热反应的是( )
A. Ba(OH)28H2O与NH4Cl反应 B. 灼热的碳与高温水蒸气的反应
C. 铝与稀盐酸 D. H2与O2的燃烧反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com