
| 选项 | 实验目的 | 实验操作 |
| A | 分离苯和四氯化碳 | 用分液漏斗进行分液 |
| B | 制备Fe(OH)3胶体 | 向饱和FeCl3溶液中滴加氨水并不断搅拌 |
| C | 除去Na2CO3固体中的NaHCO3 | 用酒精灯灼烧固体混合物 |
| D | 制取NH3 | 直接加热NH4Cl固体,用向下排空气法收集气体 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.苯和四氯化碳互溶;
B.向饱和FeCl3溶液中滴加氨水,生成氢氧化铁沉淀;
C.碳酸氢钠不稳定,加热分解生成碳酸钠;
D.氯化铵分解生成的氯化氢、氨气易重新反应生成氯化铵.
解答 解:A.苯和四氯化碳互溶,溶液不分层,不能用分液的方法分离,故A错误;
B.向饱和FeCl3溶液中滴加氨水,生成氢氧化铁沉淀,实验室制备氢氧化铁胶体,可在沸水中滴加氯化铁饱和溶液,故B错误;
C.碳酸氢钠不稳定,加热分解生成碳酸钠,可用加热的方法除杂,故C正确;
D.氯化铵分解生成的氯化氢、氨气易重新反应生成氯化铵,应用氢氧化钙和氯化铵在加热的条件下制备氨气,故D错误.
故选C.
点评 本题考查较为综合,涉及物质的分离、制备,为高考常见题型,侧重考查学生的分析能力和实验能力,注意把握物质的性质以及实验的严密性和可行性的评价,难度不大.


科目:高中化学 来源: 题型:选择题
| H2(g) | Br2(g) | HBr(g) | |
| 1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | a | 369 |
| A. | 404 | B. | 230 | C. | 200 | D. | 260 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100g质量分数为46%的乙醇溶液中所含的氢原子数为12NA | |
| B. | pH=1的硫酸溶液中含有的SO42-数目为0.05NA | |
| C. | 向1L0.3mol•L-1NaOH溶液中通入0.2molCO2,溶液中CO32-和HCO3-的数目均为0.1NA | |
| D. | 0.2molNH3与0.3molO2在催化剂的作用下加热充分反应,所得NO的分子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
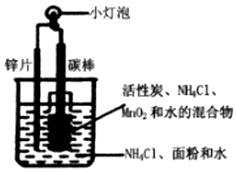 干电池模拟实验装置如图.下列说法不正确的是( )
干电池模拟实验装置如图.下列说法不正确的是( )| A. | 碳棒作正极,锌片作负极 | |
| B. | 电流方向从碳棒流向锌片,电子则相反 | |
| C. | NH4Cl是电解质,在锌片逐渐消耗过程中 MnO2不断被还原 | |
| D. | 该电池是二次电池,该废旧电池中锌可回收 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| B. | 50mL18mol•L-1浓硫酸与足量铜供热,转移电子数为0.9NA | |
| C. | 0.1molCl2通入含0.1molFeBr2溶液中,被氧化的溴离子数为0.2NA | |
| D. | 标准状况下,2.24LNO和足量O2反应生成物中含有NO2分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)=0.1 mo1•L-1 | B. | c(CO32-)>c(OH-) | ||
| C. | c(HCO3-)>c(CO32-) | D. | c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgCO3可以除去MgCl2酸性溶液中的Fe3+ | |
| B. | 实验测得NaHSO3溶液的pH<7,说明则H2SO3是强酸 | |
| C. | 通过化学变化可以“点石成金”,即可将黏土转化成金单质 | |
| D. | 2.24LNO与1.12O2充分反应所得气体中原子数目一定为0.3×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com