
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| ||


科目:高中化学 来源: 题型:
| A、①③ | B、②④ | C、②③ | D、④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、④⑤⑥ |
| C、①③④ | D、②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
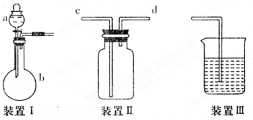 某实验小组利用如图所示装置完成有关实验.
某实验小组利用如图所示装置完成有关实验.查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
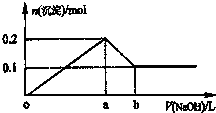 在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,理论上,加入NaOH的体积和所得沉淀的物质的量的示意图如下,b处NaOH的体积为1L,则下列判断正确的是( )
在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,理论上,加入NaOH的体积和所得沉淀的物质的量的示意图如下,b处NaOH的体积为1L,则下列判断正确的是( )| A、混合溶液中Al3+的物质的量为0.1mol |
| B、NaOH的浓度为0.5 mol/L |
| C、在b点处溶液中的溶质只有NaAlO2 |
| D、图中线段oa:ab=4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SiO2既能溶于NaOH溶液又能溶于HF溶液,说明SiO2是两性氧化物 |
| B、SO2能使溴水、酸性高锰酸钾溶液褪色,说明SO2具有漂白性 |
| C、钠是一种具有强还原性的金属,可从TiCl4溶液中置换出钛 |
| D、常温下干燥氯气与铁不反应,可以用钢瓶储存液氯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 石蕊试纸检验气体 | 容量瓶 | 集气瓶收集氯化氢 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com