
| 元素 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原分子,其氢化物水溶液呈碱性 |
| Z | 第三周期元素的金属阳离子中半径最小 |
| W | 单质制成的高压灯,发出的黄光透雾力强、射程远.且其单质燃烧后生成淡黄色固体 |
分析 短周期元素中,X元素最外层电子数是次外层电子数的2倍,则X为碳元素;常温下Y的单质为双原子分子,其氢化物水溶液呈碱性,则Y为氮元素;Z的离子是第三周期元素的简单离子中半径最小,则Z为铝元素;W的单质制成的高压灯,发出的黄光透雾力强、射程远,且其单质燃烧后生成淡黄色固体,则W为钠元素.
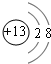
(1)Z为铝元素,其离子核外有10个电子,有2个电子层,各层电子数为2、8;
(2)单质钠燃烧后生成过氧化钠;
(3)元素Y与氢元素形成一种离子NH4+,利用“与碱反应生成氨气,氨气能产生使湿润的红色石蕊试纸变蓝”进行检验;
(4)Z元素最高价氧化物对应的水化物氢氧化铝,W元素最高价氧化物对应的水化物为NaOH,二者反应生成偏铝酸钠与水;
(5)同周期自左而右元素非金属性增强,可以利用氢化物稳定性、最高价含氧酸的酸性等判断非金属性强弱,与单质的状态无关.
解答 解:短周期元素中,X元素最外层电子数是次外层电子数的2倍,则X为碳元素;常温下Y的单质为双原子分子,其氢化物水溶液呈碱性,则Y为氮元素;Z的离子是第三周期元素的简单离子中半径最小,则Z为铝元素;W的单质制成的高压灯,发出的黄光透雾力强、射程远,且其单质燃烧后生成淡黄色固体,则W为钠元素.
(1)元素X的元素名称是碳,元素Z为铝元素,其离子结构示意图为 ,
,
故答案为:碳; ;
;
(2)元素W的单质钠燃烧后生成淡黄色固体--过氧化钠,化学方程式为:2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2,
故答案为:2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2;
(3)元素Y与氢元素形成一种离子NH4+,则检测溶液中存在该离子的方法是:取溶液少许,向溶液中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+,反之,不存在NH4+,
故答案为:取溶液少许,向溶液中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+,反之,不存在NH4+;
(4)Z元素最高价氧化物对应的水化物氢氧化铝,W元素最高价氧化物对应的水化物为NaOH,二者反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(5)碳与氮相比,非金属性较强的是N,
a.元素的非金属性强弱与该元素的单质在常温下的状态无关,故错误;
b.元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强,故正确;
c.元素的非金属性越强,其形成的气态氢化物越稳定,故正确,
故答案为:N;bc.
点评 本题考查利用结构、位置和性质的关系来推断元素,然后利用元素化合物知识来解答,难度不大,注意金属性、非金属性强弱比较事实.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源:2016-2017学年湖北省高二上月考一化学卷(解析版) 题型:选择题
某反应由两步反应A B
B C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述正确的是
C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述正确的是

A.两步反应均为吸热反应
B.三种化合物中C最稳定
C.加入催化剂会改变反应的焓变
D.整个反应中ΔH=E1-E4
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | ①③④⑤⑥ | C. | ①③⑤ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度下,0.2mol•L-1醋酸溶液与0.1mol•L-1醋酸中的c(H+ )之比 | |
| B. | 在Na2O2晶体中阳离子与阴离子的物质的量之比 | |
| C. | 液面均在“0”刻度时,50mL碱式滴定管和25mL碱式滴定管所盛溶液的体积之比 | |
| D. | 22.4LCO2与22.4L CO所含氧原子数目之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能被银氨溶液氧化 | |
| B. | 能使高锰酸钾酸性溶液褪色 | |
| C. | 1mol该有机物只能与1molBr2发生加成反应 | |
| D. | 1mol该有机物只能与1molH2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{7}$(1-a) | B. | $\frac{3}{4}$a | C. | $\frac{6}{7}$ (1-a) | D. | $\frac{12}{13}$ (1-a) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com