
将CO2气体通入CaCl2溶液中,若要有白色沉淀产生,可加入的试剂是( )
A.硫酸氢钾溶液 B.碳酸氢钙溶液
C.氯水 D.氢氧化钠溶液
科目:高中化学 来源: 题型:
能正确表示下 列反应的离子方程式是
列反应的离子方程式是
A.Cl2通入NaOH溶液:Cl2+OH-=Cl-+ClO-+H2O
B.NaHCO3溶液中加入稀HCl:CO32-+2H+=CO2↑+H2O
C.A lCl3溶液中加入过量稀氨水:Al3++4NH3·H2
lCl3溶液中加入过量稀氨水:Al3++4NH3·H2 O=AlO2
O=AlO2 -+4NH4++2H2O
-+4NH4++2H2O
D.Cu溶于稀HNO3:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数 的数值。下列说法正确的是
的数值。下列说法正确的是
A.1mol甲苯含有6NA个C-H键
B.18gH2O含有10NA个质子
C.标准状况下,22.4L氨水含有NA个NH3分子
D.56g铁片投入足量浓硫酸中生成NA个SO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
若NA表示阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,2.24 L Cl2与过量的稀NaOH 溶液反应,转移0.2NA个电子
B.1 mol·L-1 CaCl2溶液含有2NA个Cl-
C.在标准状况下,22.4 L空气中约有NA个气体分子
D.25 ℃时,1 L pH=13的Ba(OH)2溶液中含有0.1NA个Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
漂白粉是一种常用的消毒剂。
(1)工业上生产漂白粉反应的化学方程式为__________________________________________
________________________________________________________________________,
漂白粉的有效成分为________。
(2)某探究小组从市场上购买了一袋包装破损的漂白粉,对该漂白粉的成分进行探究。根据下列试剂,设计实验方案,进行实验。请在答题卡上完成实验报告。
限选试剂:2 mol·L-1 NaOH溶液 、2 mol·L-1 HCl溶液、2 mol·L-1 HNO3溶液、0.5 mol·L-1 BaCl2溶液、0.01 mol·L-1 AgNO3溶液、澄清石灰水、石蕊试液、酚酞试液、蒸馏水。
、2 mol·L-1 HCl溶液、2 mol·L-1 HNO3溶液、0.5 mol·L-1 BaCl2溶液、0.01 mol·L-1 AgNO3溶液、澄清石灰水、石蕊试液、酚酞试液、蒸馏水。
| 实验步骤 | 预期现象与结论 |
| 步骤1:取适量漂白粉溶于足量蒸馏水,充分搅拌,静置,过滤,得沉淀和滤液。 | |
| 步骤2:向沉淀加入适量2 mol·L-1 HCl溶液,将产生的气体通入________________________________________________________________________ ________________________________________________________________________ | 现象:________________________________________________________________________ 结论:________________________________________________________________________ |
| 步骤3:取滤液分装A、B两支试管。向A试管,________________________________________________________________________ | 现象:溶液先变红色,然后褪色。 结论:________________________________________________________________________ |
| 步骤4:向B试管,________________________________________________________________________ ________________________________________________________________________ | 现象:产生白色沉淀。 结论:________________________________________________________________________ |
(3)探究小组为测定漂白粉中Ca(ClO)2的含量:称取漂白粉b g加水溶解后配制成100 mL溶液,准确量取25.00 mL于锥形瓶并加入足量盐酸和KI溶液,充分反应后,溶液中的游离碘用0.100 0 mol/L的Na2S2O3溶液滴定,滴定2次,平均消耗Na2S2O3溶液20.00 mL。则该漂白粉中Ca(ClO)2的质量分数为________________________________________________________________________。
(只列算式,不做运算,已知:Mr[Ca(ClO)2]=143;Ca(ClO)2+4HCl===2Cl2↑+CaCl2+2H2O,2Na2S2O3+I2===Na2S4O6+2NaI)
查看答案和解析>>
科目:高中化学 来源: 题型:
燃烧0.1 mol两种气态烃的混合物,生成3.58 L CO2(标准状况)和3.6 g H2O,则混合气体中( )
A.一定有甲烷 B.一定有乙烷
C.一定无甲烷 D.一定有丙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化锰可用作干电池去极剂,合成工业的催化剂和氧化剂,玻璃工业和搪瓷工业的着色剂、消色剂、脱铁剂等。
Ⅰ(1)锌—锰碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。电池的总反应式为Zn(s)+2MnO2(s)+H2O(l)===Zn(OH)2(s)+Mn2O3(s)。
电池的正极反应式为________________________________
Ⅱ某化学研究性学习小组拟从废旧干电池中回收二氧化锰制取碳酸锰。
①将干电池剖切、分选得到黑色混合物(主要成分为MnO2)洗涤、过滤、烘干。
②将上述固体按固液体积比2:9加入浓盐酸、加热,反应完全后过滤、浓缩。
③向上述溶液中加入Na2CO3溶液,边加边搅拌,再过滤即可得到碳酸锰。
(2)在第②步中,将上述固体与浓盐酸混合的目的是________________________________
(3)有人认为,将第③步中的Na2CO3溶液换成NH4HCO3溶液,也能达到上述目的,但同时有气体生成。请写出加入NH4HCO3溶液时发生的离子反应方程式:
_______________________________________
Ⅲ 湿法炼锰即电解硫酸锰溶液法。电解锰的生产过程分为化合浸取、氧化净化及沉淀除杂、产品回收。其生产工艺流程如下:
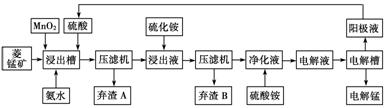
已知:①菱锰矿中主要成份是碳酸锰,主要杂质是Fe2+、Co2+、Ni2+。
②生成氢氧化物的pH如下表:(若某离子浓度小于等于10-5mol/L,则认为完全沉淀)
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 |
| 完全沉淀pH | 9.7 | 8.4 | 8.2 | 9.8 |
③有关难溶氢氧化物和硫化物pKsp数据(pKsp=-lgKsp):
| 难溶物质 | Fe(OH)3[来源:全,品…中&高*考+网] | Ni(OH)2 | Co(OH)2 | NiS | CoS |
| pKsp | 38.55 | 15.26 | 14.7 | 18.49 | 20.40 |
(4)菱锰矿粉与硫酸反应的化学方程式是________________________________。
(5)使用氨水的目的是调节pH值在________之间(填pH范围,精确到小数点后1位数字)。
在“浸出液”中加入(NH4)2S(硫化铵)的目的是_________________________________
(6)电解槽中使用的是惰性电极板,电解反应方程式为_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:①2FeCl3+2KI===2FeCl2+2KCl+I2 ②2FeCl2+Cl2===2FeCl3 ③I2+SO2+2H2O===H2SO4+2HI,判断下列物质的还原性由大到小的顺序是( )
A.I->Fe2+>Cl->SO2 B.Cl->Fe2+>SO2>I-
C.Fe2+>I->Cl->SO2 D.SO2>I->Fe2+>Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com