
| A. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | B. | 碱性:KOH>NaOH>Mg(OH)2 | ||
| C. | 熔沸点:HI>HBr>HCl>HF | D. | 稳定性:HF>H2O>H2S |
分析 A.元素非金属性越强,其最高价氧化物的水化物酸性越强;
B.元素的金属性越强,其最高价氧化物的水化物碱性越强;
C.氢化物都是分子晶体,熔沸点与其相对分子质量成正比,但含有氢键的熔沸点最高;
D.元素的非金属性越强,其氢化物的稳定性越强.
解答 解:A.元素非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Cl>S>P>Si,所以酸性:HClO4>H2SO4>H3PO4>H2SiO3,故A正确;
B.元素的金属性越强,其最高价氧化物的水化物碱性越强,金属性:K>Na>Mg,所以碱性:KOH>NaOH>Mg(OH)2,故B正确;
C.氢化物都是分子晶体,熔沸点与其相对分子质量成正比,但含有氢键的熔沸点最高,HF中含有氢键,所以其熔沸点最高,熔沸点:HF>HI>HBr>HCl,故C错误;
D.元素的非金属性越强,其氢化物的稳定性越强,非金属性F>O>S,所以氢化物的稳定性HF>H2O>H2S,故D正确;
故选C.
点评 本题考查元素周期律,明确金属性、非金属性与其最高价氧化物的水化物酸碱性的关系是解本题关键,注意:非金属性强弱影响化学键,但不影响物质熔沸点高低,分子间作用力与氢键影响共价化合物熔沸点高低,为易错点.


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| A. | 以石墨作电极电解氯化铝溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| B. | 向FeI2溶液中通入足量的氯气:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | |
| C. | 少量硫酸氢钠溶液和氢氧化钡溶液混合:Ba2++SO42-+2H++2OH-═BaSO4↓+2H2O | |
| D. | 硝酸铁溶液中滴加足量HI溶液:Fe3++3NO3-+12H++10I-═Fe2++5I2+3NO↑+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol金刚石晶体中含碳碳键数为2NA | |
| B. | 常温常压下,22.4L的D2、H2组成的气体分子数约为NA | |
| C. | 标准状况下,22.4LSO3中含有的氧原子数约为3 NA | |
| D. | 1molNa2O2与足量CO2反应转移的电子数2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
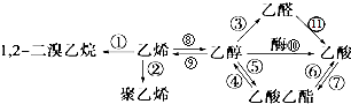
| A. | 有①②⑧三个反应均属于加成反应 | B. | 只有②发生的是加聚反应 | ||
| C. | 总共有4个反应是氧化反应 | D. | 反应④⑤⑥⑦是取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用天然气做燃料可以有效地减少“温室效应”的气体产生 | |
| B. | 由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中药的有效成分 | |
| C. | 可以用浸泡过高锰酸钾溶液的硅土来吸收水果或花朵产生的乙烯,达到保鲜目的 | |
| D. | 福尔马林是甲醛的水溶液,具有杀菌防腐能力,但不能用福尔马林保鲜鱼肉等食品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 元素W、X的氯化物中,各原子均满足最外层8电子的稳定结构 | |
| B. | 元素X与W形成的原子数比为1:1的化合物有很多种,且都存在非极性键 | |
| C. | 非金属性:Z>X | |
| D. | 元素Z可与元素Y形成化合物Y2Z3,该化合物易水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 编号 | ① | ② | ③ | ④ |
| 稀硝酸的体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属的质量/g | 18.0 | 9.6 | 0 | 0 |
| NO的体积/mL | 2240 | 4480 | 6720 | V |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com