
 ④HCl ⑤C2H4 ⑥Br2 ⑦HNO3 ⑧SO2.
④HCl ⑤C2H4 ⑥Br2 ⑦HNO3 ⑧SO2. 科目:高中化学 来源: 题型:选择题
| A. | “酸雨”、“温室效应”的形成都与化石燃料的燃烧有关 | |
| B. | NaHCO3是焙制糕点所用的发酵粉的主要成分之一 | |
| C. | 氢氧化铁胶体具有吸附性,因而常用于净水 | |
| D. | 硫酸钡在医学上用作钡餐,Ba2+对人体无毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

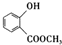 .
. +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$ +CH3COONa+CH3OH+H2O.
+CH3COONa+CH3OH+H2O. (写出其中一种的结构简式).
(写出其中一种的结构简式). )是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用).
)是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2CO3和HNO3;NaHCO3和HNO3 | B. | BaCl2和Na2CO3;Ba(OH)2和K2CO3 | ||
| C. | Ba(OH)2和NaHSO4;Ba(OH)2和H2SO4 | D. | NaOH和HF;Ba(OH)2和HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HI比HCl稳定 | |
| B. | HI比HCl熔、沸点高 | |
| C. | 溶于水时,HI比HCl更容易电离,所以氢碘酸是强酸 | |
| D. | 拆开等物质的量的HI和HCl,HI消耗的能量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
; HClO+OH-;
HClO+OH-;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-) | |
| B. | 0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) | |
| C. | 向醋酸钠溶液中加入等量醋酸,得到的酸性混合溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 等物质的量浓度的①NH4Cl溶液 ②(NH4)2SO4溶液 ③NH4HSO4溶液④(NH4)2 CO3 溶液中NH4+浓度的大小关系是②>④>①>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸银溶液 | B. | 溴水 | ||
| C. | 酸性高锰酸钾溶液 | D. | 氯化铁溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com