
【题目】(1)写出下列物质在水中的电离方程式
碳酸氢钠______________________________________________________________。
亚硫酸________________________________,______________________________。
(2)已知25 ℃时有关弱酸的电离平衡常数如下:HCN:4.9×10-10,H2CO3:K1=4.4×10-7 K2=4.7×10-11,向NaCN溶液中通入少量二氧化碳气体,写出发生反应的离子方程式_____。
【答案】 NaHCO3===Na++HCO3— H2SO3 ![]() H+ + HSO3— HSO3—
H+ + HSO3— HSO3— ![]() H+ + SO32— H2O+CO2+CN—=HCN+HCO3—
H+ + SO32— H2O+CO2+CN—=HCN+HCO3—
【解析】(1)①碳酸氢钠属于弱酸的酸式盐,电离方程式为NaHCO3=Na++HCO3—,故答案为:NaHCO3=Na++HCO3—;
②亚硫酸是弱酸,分步电离,电离方程式为H2SO3 ![]() H+ + HSO3—、HSO3—
H+ + HSO3—、HSO3—![]() H+ + SO32—,故答案为:H2SO3
H+ + SO32—,故答案为:H2SO3![]() H+ + HSO3—;HSO3—
H+ + HSO3—;HSO3—![]() H+ + SO32—;
H+ + SO32—;
(2)弱酸的电离平衡常数越大,其酸性越强,酸性强弱顺序为H2CO3>HCN>HCO3-,依据强酸制取弱酸的原理,NaCN溶液中通入少量的CO2离子方程式为:CN-+H2O+CO2=HCN+HCO3-,故答案为:CN-+H2O+CO2=HCN+HCO3-。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】在实验室中,对下列事故或药品的处理正确的是( )
A. 有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,并迅速离开现场
B. 金属钠着火燃烧时,用泡沫灭火器灭火
C. 少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗
D. 含硫酸的废液倒入水槽,用水冲入下水道
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应由两步反应A→B、B→C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述正确的是

A. 两步反应均为吸热反应 B. 三种化合物中C最稳定
C. 加入催化剂会改变反应的焓变 D. 整个反应的ΔH=E1-E2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇催化氧化为乙醛过程中化学键的断裂与形成情况可表示如图: 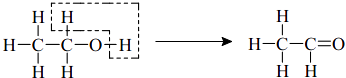
(注:含﹣CHO的物质为醛类化合物)
下列醇能被氧化为醛类化合物的是( )
A.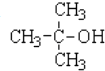
B.![]()
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应过程中,不仅有物质的变化,同时还伴随有能量的变化。
(1)已知几种化学键的键能如表所示:
化学键 | Cl—Cl | F—F | Cl—F |
键能/ kJ·mol—1 | 242 | 159 | 172 |
则反应Cl2(g)+ 3F2(g)![]() 2ClF3(g) 的△H=_____________ kJ·mol—1 。
2ClF3(g) 的△H=_____________ kJ·mol—1 。
(2)如图是乙烷、二甲醚燃烧过程中的能量变化图。

请回答下列问题:
①乙烷的燃烧热ΔH=____kJ·mol-1。
②等物质的量的液态乙烷比气态乙烷完全燃烧生成稳定的氧化物时放出的热量__(填“多”或“少”)。
③根据题图写出二甲醚完全燃烧时的热化学方程式_____________。
(3)实验室用50mL 0.50mol·L﹣1HCl与50mL 0.55mol·L﹣1NaOH溶液测定中和热。
①若改用60mL HCl进行实验,与原实验相比,所放出的热量____(填“相等”或“不相等”,忽略实验本身误差,下同),所求中和热_____(填“相等”或“不相等”,)。
②若用相同浓度和体积的氨水代替NaOH溶液进行上述实验,所求中和热数值会___(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如表且原子序数按XYTZ依次增大:
元素编号 | 元素性质或原子结构 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
T | 最外层电子数是电子层数的2倍 |
Z | 元素最高正价是+7价 |
(1)四种元素原子半径由大到小的顺序是(写元素符号) .
(2)元素Y与氢元素形成的一种离子YH4+ , 写出该微粒的电子式(用元素符号表示).
(3)T元素的简单阴离子的结构示意图是 ,
(4)证明该粒子的还原性比Z﹣强的离子方程式是 .
(5)元素Z的单质与氢氧化钠溶液反应的化学方程式为 .
(6)将9g单质X在足量氧气中燃烧,所得气体通入1L 1molL﹣1NaOH溶液中,完全吸收后,将溶液在减压低温条件下蒸干,得到不含结晶水的固体质量为g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为探究金属Al在酸性或碱性溶液中均可与NO3-发生氧化还原反应,进行如下实验:
①将Al加入到pH=2的HNO3溶液中,Al溶解,得到溶液A,产生无色气体C,气体C在空气中转化为红棕色气体E;
②将Al 加入到pH=12的KNO3和KOH混合溶被中,Al溶解,得到溶液B,产生无色有刺激性气味的气体D;
③在A溶液中通入气体D,最终产生大量的白色沉淀;
④在B溶液中通入气体E,先出现白色沉淀,而后白色沉淀溶解。
请回答下列问题:
(1)Al与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是_______。
(2)E和D在一定条件下反应生成两种对环境无污染的物质,则该反应的化学方程式为_______。
(3)已知A和B两溶液混合产生白色沉淀,该反应的离子方程式为_______。
(4)以Al和Fe作电极,在碱性、NO3-存在条件下形成原电池,则Fe电极反应式为_______。
(5)除去气体C中混有的少量E的操怍是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由短周期主族元素X,Y,Z组成的单质(化学式也分别为X,Y,Z),X为金属,其核外电子数为Y原子序数的2倍,Y的最低负化合价与Z的最高正化合价的数值相等,甲、乙、丙、丁四种均为氧化物,甲和丁为无色的气体,晶体甲可用于人工降雨,乙和丙熔点均很高,且它们在一定条件下能发生如下反应,下列说法中正确的是( ) 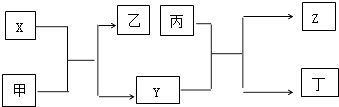
A.X为第三周期Π族元素,Y和Z位于同一主族
B.甲、乙、丙均能与水发生化合反应
C.晶体甲、乙、丙分别分子晶体、离子晶体和原子晶体
D.X可用于制焰火烟花,丙可用于作太阳能电池的材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com