
����Ŀ����1����Cu ��CO2 ��H2SO3��H2O��Һ̬HCl ��H2SO4��Ba��OH��2 ��NaCl ������ ��NaOH��Һ
�������������ڵ���ʵ���______________�����ڷǵ���ʵ���________���ܵ������_________�� ������ţ�������ȫ�����÷֣�
��2����16g��������ԭ��������ͬ�İ�����_________________g��
��3����֪ʵ������ȡ�����ķ�Ӧԭ��ΪMnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O
MnCl2+Cl2��+2H2O
���÷�Ӧ���������ͻ�ԭ�������ʵ���֮��Ϊ________
�ڵ�2 mol MnO2�μӷ�Ӧʱת�Ƶ���______mol
�۵�ת��1 mol����ʱ�����ɱ�״���µ�Cl2______L
��Ũ�����ڷ�Ӧ����ʾ������������______������ĸ��
a.��ԭ�� b.���� c.������ d. �ӷ���
���𰸡� �ۢܢݢޢߢ� �ڢ� �٢� 4.25 1:2 4 11.2 ab
��������(1)��CuΪ�������ʣ����������ƶ��ĵ��ӣ��ܵ��磬�Ȳ��ǵ����Ҳ���Ƿǵ���ʣ���CO2���ܵ��磬���������ܵ��룬�Ƿǵ���ʣ���H2SO3���ܵ��磬��ˮ��Һ���ܵ��磬�ǵ���ʣ���H2O���ܵ��磬�ǵ���ʣ���Һ̬HCl ���ܵ��磬��ˮ��Һ���ܵ��磬�ǵ���ʣ���H2SO4���ܵ��磬��ˮ��Һ���ܵ��磬�ǵ���ʣ���Ba��OH��2���ܵ��磬��ˮ��Һ���ܵ��磬�ǵ���ʣ���NaCl���ܵ��磬��ˮ��Һ���ܵ��磬�ǵ���ʣ������Dz��ܵ��磬�Ƿǵ���ʣ���NaOH��Һ�ǻ����ܵ��磬�Ȳ��ǵ����Ҳ���Ƿǵ���ʣ������ڵ���ʵ��Ǣۢܢݢޢߢࣻ���ڷǵ���ʵ��Ǣڢ�ܵ�����Ǣ٢⣻��Ϊ���ۢܢݢޢߢ����ڢ����٢���
��2��n��O2��=![]() =
=![]() =0.5mol,n��O��=0.5mol��2=1mol �� n��NH3��=
=0.5mol,n��O��=0.5mol��2=1mol �� n��NH3��=![]() =0.25mol����m��NH3��=0.25mol��17g/mol=4.25g������4.25
=0.25mol����m��NH3��=0.25mol��17g/mol=4.25g������4.25
��3����MnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O�У�MnԪ�صĻ��ϼ۽��ͣ���MnO2Ϊ��������ClԪ�صĻ��ϼ����ߣ���������HClΪ��ԭ��������4molHCl��ֻ��2mol������ �����Ը÷�Ӧ���������ͻ�ԭ�������ʵ���֮��Ϊ��1:2 ,��Ϊ��1:2
MnCl2+Cl2��+2H2O�У�MnԪ�صĻ��ϼ۽��ͣ���MnO2Ϊ��������ClԪ�صĻ��ϼ����ߣ���������HClΪ��ԭ��������4molHCl��ֻ��2mol������ �����Ը÷�Ӧ���������ͻ�ԭ�������ʵ���֮��Ϊ��1:2 ,��Ϊ��1:2
��MnԪ�صĻ��ϼ���+4�۽�Ϊ+2�ۣ���1molMnO2�μӷ�Ӧʱ��ת�Ƶ��ӵ����ʵ���=1mol��(4-2)=2mol����2 mol MnO2�μӷ�Ӧʱת�Ƶ��������ʵ���=2mol��2=4mol ��Ϊ��4
��ÿת��2mol�������ɱ�״����Cl2�����ʵ���Ϊ1mol����ת��1mol�������ɱ�״����Cl2�����ʵ���Ϊ0.5mol�����Ϊ��11.2L,��Ϊ��11.2L,
�ܸ÷�Ӧ�У�Ũ�����е���Ԫ�ز���ʧȥ��������ԭ�������ֻ��ϼ۲��䣬���ᣬ����Ũ�����ڷ�Ӧ����ʾ�����������ǻ�ԭ�Ժ����ԣ���Ϊ��ab



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ǻ�ѧ�о��Ļ������������и�ʵ��װ��ͼ�������У���ȷ���ǣ� �� 
A.װ�âٳ����ڷ���е㲻ͬ��Һ������
B.װ�â��������հ������ܹ���ֹ����
C.��NH4ClΪԭ�ϣ�װ�âۿ��Ʊ�����NH3
D.װ�â�a�ڽ������ռ�Cl2��NO����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����е�������������ʱ����Ӧ�������¶ȡ���Ӧ���������ı䣬�����������ı����
A. Fe��HCl B. Ca(OH)2��CO2 C. Na��O2 D. C��O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������֪HCO3��+AlO2��+H2O�TCO32��+Al��OH��3������������KHCO3��Һ���ϵ��뺬�����ʵ�����KOH��Ba��OH��2��KAlO2�Ļ����Һ�У����ɳ��������ʵ���������KHCO3��Һ����Ĺ�ϵ�ɱ�ʾΪ�� ��
A.
B.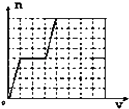
C.
D.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й�����ͼ��ķ���������ǣ� ��
A. ͼ�ɱ�ʾ��ƽ��N2��g��+3H2��g��2NH3��g����ѹ��ͬʱ�Ƴ�����NH3ʱ�����ʱ仯
ͼ�ɱ�ʾ��ƽ��N2��g��+3H2��g��2NH3��g����ѹ��ͬʱ�Ƴ�����NH3ʱ�����ʱ仯
B.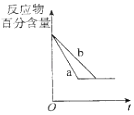 ͼ��a��b����ֻ�ɱ�ʾ��ӦH2��g��ʮI2��g��2HI��g�����д��������������½���ƽ��Ĺ���
ͼ��a��b����ֻ�ɱ�ʾ��ӦH2��g��ʮI2��g��2HI��g�����д��������������½���ƽ��Ĺ���
C. ͼ��ʾ��CH3COOH��Һ������CH3COONa�������ҺpH�ı仯
ͼ��ʾ��CH3COOH��Һ������CH3COONa�������ҺpH�ı仯
D. ͼ��ʾ�������Һ�м�ˮʱ�䵼���Ա仯����CH3COOH��Һ��pH��a��b
ͼ��ʾ�������Һ�м�ˮʱ�䵼���Ա仯����CH3COOH��Һ��pH��a��b
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������C11H12O3�����Ʊ�Һ�����ϵ��м���֮һ��������к���ȩ�����������������E��H��һ�������ºϳɣ� 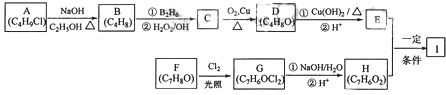
��֪������Ϣ��
A�ĺ˴Ź������ױ�����ֻ��һ�ֻ�ѧ�������⣻R��CH�TCH2![]() R��CH2CH2OH
R��CH2CH2OH
������F�����ϵ�һ�ȴ���ֻ�����֣�
ͨ����ͬһ��̼ԭ�������������ǻ����ȶ�������ˮ�γ��ʻ���
�ش��������⣺
��1��A�Ļ�ѧ����Ϊ ��
��2��D�Ľṹ��ʽΪ ��
��3��E�ķ���ʽΪ ��
��4��F����G�Ļ�ѧ����ʽΪ �� �÷�Ӧ����Ϊ ��
��5��I�Ľṹ��ʽΪ ��
��6��I��ͬϵ��J��I��Է�������С14��J��ͬ���칹������ͬʱ�������������� �ٱ�����ֻ������ȡ�������ڼ��ܷ���������Ӧ�����ܺͱ���NaHCO3��Һ��Ӧ�ų�CO2 �� �����֣������������칹����J��һ��ͬ���칹�巢��������Ӧ���ữ��˴Ź�������Ϊ����壬�ҷ������Ϊ2��2��1��д��J������ͬ���칹��Ľṹ��ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ش��������⣺
��1����ˮ��T��ʱ��pH=6�����¶���1molL��1��NaOH��Һ�У���ˮ�������c��OH����=molL��1 ��
��2��ijһԪ������Һ��A�����Ԫǿ�ᣨB����pH��ȣ���������Һϡ����ͬ�ı�����pH��A��pH��B�� �����������=������������������ϡ����Һ�к͵�Ũ�ȵ������NaOH��Һ������ϡ����Һ�����V��A��V��B�������������=����������
��3����֪����Ԫ��H2R �ĵ��뷽��ʽ�ǣ�H2R=H++HR�� �� HR��R2��+H+ �� ��0.1molL��1NaHR��Һ��c��H+��=a molL��1 �� ��0.1molL��1H2R��Һ��c��H+����0.1+a�� molL��1�����������������=������������ ��
��4������ƽ�ⳣ���Ǻ���������ʵ���̶ȵ�����������֪��
��ѧʽ | ���볣����25�棩 |
HCN | K=4.9��10��10 |
CH3COOH | K=1.8��10��5 |
H2CO3 | K1=4.3��10��7��K2=5.6��10��11 |
��25��ʱ���е�Ũ�ȵ�HCN��Һ��H2CO3��Һ��CH3COOH��Һ������Һ��pH�ɴ�С��˳��Ϊ���û�ѧʽ��ʾ����
����NaCN��Һ��ͨ��������CO2 �� ������Ӧ�Ļ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯�У������ڻ�ѧ�仯���ǣ� ��
A.��ˮʹ��ɫ������ɫ
B.����ʹijЩȾ����ɫ
C.����̿ʹ��īˮ��ɫ
D.��������ʹƷ����Һ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijCr2O3��Ʒ�к�������Al2O3��MgO�����ʣ�ʵ�����Դ���ƷΪ��Ҫԭ����ȡ�ظ���أ�K2Cr2O7�����������£� 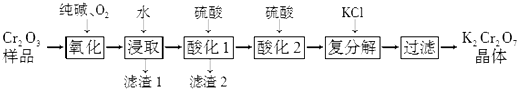
��֪��2CrO42��+2H+Cr2O72��+H2O��
��1���������������У�����1mol Cr2O3ת����Na2CrO4 �� �����������������״������ ��
��2���ữ1��Ϊȷ����Һ��Al3+��AlO2��Ũ�Ⱦ�������10��6 molL��1 �� �������ҺpH�ķ�Χ�� �� ��֪��Al��OH��3��s��H++AlO2��+H2O��K=1��10��14��Ksp[Al��OH��3]=1��10��33
��3���ữ2��������Һ����KCl�������ֽⷴӦ���÷�Ӧ�ܷ�����ԭ���� ��
��4����ȡ�ظ��������2.40g ���250mL��Һ��ȡ��25.00mL�ڵ���ƿ�У�����ϡ����������⻯�أ�������ԭΪCr3+�������ڰ���6min���ң�Ȼ���������ˮ�����ε���ָʾ������0.24molL��1 Na2S2O3����Һ�ζ����յ㣨������Ӧ��I2+2S2O32���T2I��+S4O62�� �� ���ʲ����뷴Ӧ��������ȥNa2S2O3����Һ20.00mL�������ò�Ʒ���ظ���ص�����������д��������̣���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com