
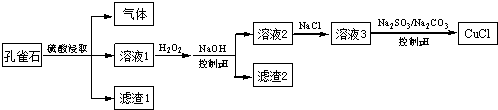
| A. | H2O2将溶液1中Fe2+氧化为Fe3+,再通过控制pH转化为Fe(OH)3除去 | |
| B. | SO32-将溶液3中的Cu2+还原,反应得到CuCl | |
| C. | CO32-作用是控制溶液pH,促使CuCl沉淀的生成 | |
| D. | 若改变试剂加入顺序,将溶液3缓慢加入到含大量SO32-/CO32-的溶液中,同样可制取CuCl |
分析 孔雀石(主要成分Cu(OH)2•CuCO3,含FeS、FeO和SiO2杂质)中用硫酸浸取,得气体主要含有硫化氢、二氧化碳,滤渣1为二氧化硅,溶液1中含有Fe2+、Fe3+、Cu2+加双氧水,将亚铁离子氧化成铁离子,加氢氧化钠溶液调节pH值,使铁离子沉淀,得到滤渣2为氢氧化铁,溶液2主要含有硫酸铜,溶液2中加入氯化钠再加入亚硫酸钠将铜离子还原成亚铜离子,加入碳酸钠调节pH值,使CuCl沉淀,由于SO32-/CO32-的溶液呈碱性,所以如果将溶液3缓慢加入到含大量SO32-/CO32-的溶液中,有可能生成氢氧化亚铜沉淀,得到的氯化亚铜不纯,据此答题.
解答 解:孔雀石(主要成分Cu(OH)2•CuCO3,含FeS、FeO和SiO2杂质)中用硫酸浸取,得气体主要含有硫化氢、二氧化碳,滤渣1为二氧化硅,溶液1中含有Fe2+、Fe3+、Cu2+加双氧水,将亚铁离子氧化成铁离子,加氢氧化钠溶液调节pH值,使铁离子沉淀,得到滤渣2为氢氧化铁,溶液2主要含有硫酸铜,溶液2中加入氯化钠再加入亚硫酸钠将铜离子还原成亚铜离子,加入碳酸钠调节pH值,使CuCl沉淀,由于SO32-/CO32-的溶液呈碱性,所以如果将溶液3缓慢加入到含大量SO32-/CO32-的溶液中,有可能生成氢氧化亚铜沉淀,得到的氯化亚铜不纯,
A、根据上面的分析可知,H2O2将溶液1中Fe2+氧化为Fe3+,再通过控制pH转化为Fe(OH)3除去,故A正确;
B、根据上面的分析可知,SO32-将溶液3中的Cu2+还原,反应得到CuCl,故B正确;
C、根据上面的分析可知,CO32-作用是控制溶液pH,促使CuCl沉淀的生成,故C正确;
D、根据上面的分析可知,将溶液3缓慢加入到含大量SO32-/CO32-的溶液中,制得的CuCl可能不纯,故D错误,
故选D.
点评 本题为工艺流程题,是高考的热点,题目难度中等,工业流程的分析是解题 的关键,注意对所学知识的迁移应用.


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4molA+2molB | B. | 3molB+1molD | ||
| C. | 2molA+1molB+3molC | D. | 1molA+0.5molB+1.5molC+0.6molD |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (a+b)×63g | B. | (a+b)×169g | C. | [Vc-$\frac{9a+b}{3}$]mol | D. | (a+b)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2L氯气所含的原子数目为NA | |
| B. | 标准状况下,1.12LO2和1.12 L CO2均含有0.1NA氧原子 | |
| C. | 标准状况下,22.4L空气含有NA个单质分子 | |
| D. | 标准状况下,22.4LH2O含有NA个水分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图所示的装置,接通电源5min后,电极3的质量增加了0.64g.
如图所示的装置,接通电源5min后,电极3的质量增加了0.64g.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.| T/K | 398 | 498 |
| 平衡常数K | K1 | K2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com