
【题目】CO2和CH4均为温室气体,若得以综合利用,对温室气体整治具有重大意义。
(1)已知:
CO2(g)+CH4(g)![]() 2CO(g)+2H2(g) △H=+247.3kJ·mol-1
2CO(g)+2H2(g) △H=+247.3kJ·mol-1
CH4(g)![]() C(s)+2H2(g) △H=+75.0kJ·mol-1
C(s)+2H2(g) △H=+75.0kJ·mol-1
反应2CO(g)![]() C(s)+CO2(g)在_______能自发进行。
C(s)+CO2(g)在_______能自发进行。
A、高温 B、低温 C、任意温度 D、任意温度都不能
(2)合成甲醇的主要反应是CO(g)+2H2(g)![]() CH3OH(g)。初始压强P1下,向体积为2L的恒容密闭容器中充入b mol CO和2b mol H2,平衡时CO的转化率与温度、压强的关系如图所示。请回答:
CH3OH(g)。初始压强P1下,向体积为2L的恒容密闭容器中充入b mol CO和2b mol H2,平衡时CO的转化率与温度、压强的关系如图所示。请回答:
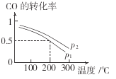
①下列判断正确的是______
A、放热反应 P1>P2 B、放热反应 P1<P2
C、吸热反应 P1>P2 D、吸热反应 P1<P2
②200℃时,该反应的平衡常数K=_______(用含b的代数式表示)。若上述反应经过tmin达到平衡,则该时间段内氢气的平均反应速率为_______。
(3)实验室可用Na2CO3 与盐酸混合制备少量CO2。在25℃时,取10.6g Na2CO3 与盐酸混合所得的一组体积为1L 的溶液,溶液中部分微粒与pH 的关系如图所示。则:
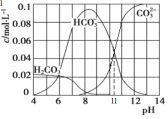
①根据图中数据,计算CO32-的水解常数K=____________________。
②pH = 6的溶液中:c(H2CO3)+ c(HCO3-)+ c(CO32-)_____(填>、<或=)0.1 mol·L-1
(4)以甲烷为燃料的酸性燃料电池负极反应式:___________________________
【答案】B B 4/b2 ![]()
![]() < CH4-8e-+2H2O=CO2+8H+
< CH4-8e-+2H2O=CO2+8H+
【解析】
(1)CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)△H═+247.3kJ/mol ①,CH4(g)
2CO(g)+2H2(g)△H═+247.3kJ/mol ①,CH4(g)![]() C(s)+2H2(g)△H═+75kJ/mol ②,将方程式②-①得2CO(g)
C(s)+2H2(g)△H═+75kJ/mol ②,将方程式②-①得2CO(g)![]() C(s)+CO2(g)△H═(+75kJ/mol)-(+247.3kJ/mol)=-172.3kJ/mol,该反应的△H<0、△S<0,如果△H-T△S<0就能自发进行;
C(s)+CO2(g)△H═(+75kJ/mol)-(+247.3kJ/mol)=-172.3kJ/mol,该反应的△H<0、△S<0,如果△H-T△S<0就能自发进行;
(2)①相同压强下,升高温度CO转化率降低,平衡逆向移动;该反应前后气体计量数之和减小,增大压强CO转化率增大;
②200℃时,CO的转化率为0.5,所以平衡时CO、H2、CH3OH的浓度分别0.25bmol/L、0.5bmol/L、0.25bmol/L,根据平衡常数的定义计算平衡常数;若200℃时,上述反应经过tmin达到平衡,氢气转化的浓度为0.5bmol/L,根据v=△c/△t计算;
(3)根据平衡常数的定义进行计算;
(4)甲烷和空气为原料,构成碱性燃料电池,负极上甲烷失电子生成碳酸根离子,据此书写电极反应式。
(1)已知:①CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)△H=+247.3kJmol-1
2CO(g)+2H2(g)△H=+247.3kJmol-1
②CH4(g)![]() C(s)+2H2(g)△H=+75.0kJmol-1,根据盖斯定很,将②-①得反应2CO(g)
C(s)+2H2(g)△H=+75.0kJmol-1,根据盖斯定很,将②-①得反应2CO(g)![]() C(s)+CO2(g)△H=-172.3kJmol-1,△H<0,而该反应△S<0,所以该反应在温度较低的条件下可以自发进行,
C(s)+CO2(g)△H=-172.3kJmol-1,△H<0,而该反应△S<0,所以该反应在温度较低的条件下可以自发进行,
故答案为:B。
(2)①根据图可知,温度越高,CO的转化率越小,所以该反应的正反应为放热反应,根据图相同温度时P2的CO的转化率大于P1,而该反应为气体体积减小的反应,压强越大,CO的转化率越高,所以P1<P2,
故答案为:B。
②200℃时,CO的转化率为0.5,所以平衡时CO、H2、CH3OH的浓度分别0.25bmol/L、0.5bmol/L、0.25bmol/L,所以平衡常数K=0.25b/(0.5b)2×0.25b=4/b2,若200℃时,上述反应经过tmin达到平衡,氢气转化的浓度为0.5bmol/L,所以该时间段内氢气的平均反应速率为0.5b/tmol/(Lmin)=b/2tmol/(Lmin),故答案为:4/b2;b/2tmol/(Lmin)。
(3)10.6g碳酸钠的物质的量为:n(Na2CO3)=10.6g/106g/mol =0.1mol,CO32-+H2O![]() HCO3-+OH-的平衡常数K=c(HCO3)c(OH)/c(CO32),由图中数据可知,当pH=11时,c(HCO3)=c(CO32),CO32-平衡常数K=c(OH)=1.0×10-3,故答案为:1.0×10-3。
HCO3-+OH-的平衡常数K=c(HCO3)c(OH)/c(CO32),由图中数据可知,当pH=11时,c(HCO3)=c(CO32),CO32-平衡常数K=c(OH)=1.0×10-3,故答案为:1.0×10-3。
②根据图象可知,pH=6时有CO2生成,根据物料守恒可知:c(H2CO3)+c(HCO3-)+c(CO32-)<0.1molL-1,故答案为:<。
(4)甲烷和空气为原料,构成碱性燃料电池,负极上甲烷失电子生成碳酸根离子,负极的电极反应式为:CH4-8e-+10OH-═CO32-+7H2O,
故答案为:CH4-8e-+10OH-═CO32-+7H2O。


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
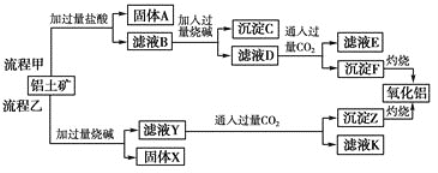
请回答下列问题:
(1) 流程乙加入烧碱后生成SiO32-的离子方程式为________________________________。
(2) 写出由滤液D生成Al(OH)3的离子方程式: ________________________________。
(3)向滤液Y中加入NaHCO3溶液,溶液的pH________(填“增大”、“不变”或“减小”)。
(4) 滤液E、K中溶质的主要成分是________(填化学式)。
(5) 已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12。取适量的滤液B,加入一定量的烧碱至达到沉淀溶解平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg2+)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组测定某Fe2(SO4)3样品(只含少量FeCl2杂质)中铁元素的质量分数,按以下实验步骤进行操作:
①称取ag样品,置于烧杯中;
②加入50 mL 1.0 mol/L稀硫酸和一定量的蒸馏水,使样品溶解,然后准确配制成250.0 mL溶液;
③量取25.0 mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦……
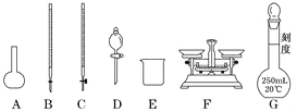
请根据上面叙述,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用到的仪器有烧杯、量筒和________(填字母)。
(2)步骤②中:配制50 mL 1.0 mol/L稀H2SO4需要98%(密度1.84 g/cm3)的浓H2SO4体积为________mL,量取该体积的浓H2SO4用到量筒规格是________。
(3)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式:
___Fe2++___ClO2+______=___Fe3++___Cl—+___H2O,从理论上分析,上述实验中若将氯水改为ClO2时,氧化等量的Fe2+消耗ClO2与Cl2的物质的量之比为________。
(4)第⑥步的操作中,将沉淀物转移到________(填仪器名称)中加热,并在干燥器中冷却到室温,称量其质量。
(5)若步骤⑥不在干燥器中冷却,则测定的铁元素的质量分数会________(填“偏大”“偏小”或“不影响”);若容器质量是W1g,最终容器和固体的总质量是W2g,则样品中铁元素的质量分数为_____(列出算式,不需化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有A、B、C、D、E、F六种装置,如图所示。请回答下列问题(橡皮管、导管可自由选用)。
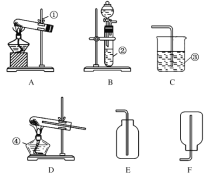

(1)实验室制取并收集氧气时应选择__________和__________相连接,制取并收集氢气时应选择__________和__________相连接。
(2)进行木炭还原氧化铜并检验生成气体的实验,应选择________和________相连接,检验气体时观察到的实验现象是__________________________________。
(3)实验室用无水醋酸钠固体和固体碱石灰加热制取甲烷气体。已知甲烷的密度比空气小,不溶于水。则制取甲烷气体可选用的装置为________,收集甲烷气体时可选用的装置为________。
(4)如图是某学生设计的一种有洗气、贮气等用途的装置。欲除去O2中混有的水蒸气,瓶中可盛________。当用排水法收集氢气时,瓶内先装满水,气体从________(填“a”或“b”,下同)导管口通入。若要用水将瓶中氢气排出,水应从________导管口进入。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O2、O3、N2、N4是氧和氮元素的几种单质。回答下列问题:
(1)O原子中价电子占据的轨道数目为______________。
(2)第一电离能I1:N__________O(填“>”或“<”),第二电离能I2:O大于N的原因是_________________。
(3)O3的空间构型为__________________;分子中存在大π键,可用符号Π![]() 表示,其中m表示形成的大π键的原子数,n表示形成的大π键的电子数,则O3中大π键应表示为___________________________________。
表示,其中m表示形成的大π键的原子数,n表示形成的大π键的电子数,则O3中大π键应表示为___________________________________。
(4)N元素的简单气态氢化物NH3在H2O中溶解度很大,其原因之一是NH3和H2O可以形成分子间氢键,则在氨水中氢键可以表示为H3N…H—N、____________________、__________________________(任写两种即可)。
(5)已知:表格中键能和键长数目。
化学键 | 键长/pm | 键能/(kJ·mol-1) |
N-N | 145 | 193 |
N=N | 125 | 418 |
N≡N | 110 | 946 |
N2和N4都是N元素的单质,其中N4是正四面体构型,N原子占据四面体的四个顶点,从键参数角度分析N4分子稳定性远小于N2原因是________________________。
(6)Na2O的晶胞结构如图所示 ,X表示O2-,Y表示Na+,则O2-的配位数为____________,该晶胞的原子空间利用率为_____________。[已知该晶胞的棱长为a pm,r(Na+)=x pm,r(O2-)=y pm]
,X表示O2-,Y表示Na+,则O2-的配位数为____________,该晶胞的原子空间利用率为_____________。[已知该晶胞的棱长为a pm,r(Na+)=x pm,r(O2-)=y pm]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在定温定容的密闭容器中合成![]() 。下列不能说明反应2SO2(g)+O2(g)
。下列不能说明反应2SO2(g)+O2(g)![]() 2SO3(g)达到化学平衡状态的是 ( )
2SO3(g)达到化学平衡状态的是 ( )
A. ![]()
B. 容器内的压强不再改变
C. SO3的生成速率与SO2 的生成速率相等
D. SO2 的转化率不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.碳酸氢钙溶液中加入少量氢氧化钠溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
B.海带灰浸泡滤液中加入稀硫酸后再加入双氧水:2I-+ H2O2+4H+ = I2+2H2O
C.用浓盐酸与MnO2反应制取少量氯气:MnO2+4H++4Cl-![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
D.1L4mol·L-1 NaOH溶液中通入67.2LCO2(标准状况下),反应的离子方程式为:4OH- +3CO2 = 2HCO3-+CO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若阿伏加德罗常数的数值用NA表示,下列说法正确的是( )
A.1.6gNH2-离子所含质子数为NA
B.常温常压下,200g8.5%的H2O2溶液中含氧原子数为NA
C.7.8gNa2O2晶体中所含离子总数为0.4NA
D.在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com