
【题目】下图是氮元素在煤粉使用过程中的转化关系:

(1)③中加入的物质可以是___________(填标号)。
a.空气b.CO c.KNO3d.NH3
已知:N2(g) +O2(g)=2NO(g) △H = a kJ·mol-1
N2(g)+3H2(g)=2NH3(g) △H = b kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H = c kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H = d kJ·mol-1
上面转化关系反应后恢复至常温常压,根据以上信息写出③中你所选物质参与反应的热化学方程
式___________(如果所选物质不只一种,则只要写出其中一个热化学方程式即可)。
(2)将烟气中的氮氧化物(NOx)转化为无害物质,这个过程称为脱硝。下面反应为处理方法之一:
4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g)△H = -1625.5kJ·mol-1
4N2(g)+6H2O(g)△H = -1625.5kJ·mol-1
①若反应生成1molN2,则反应中转移的电子数为___________mol。
②使上述反应速率增大且平衡向右移动的措施是___________。
③氨氮比[n(NH3)/n(NO)]会直接影响该方法的脱硝率。350℃时,只改变氨气的投放量,反应物X的转化率与氨氮比的关系如图所示,则X是___________(填化学式)。在体积为2L的容器中模拟进行上述反应,初始时加入8molNO和3.5molO2,氨氮比为0.5时,该反应的平衡常数K =___________(保留二位小数)。当n(NH3)/n(NO)>1.0 时,烟气中NO浓度反而增大,主要原因是___________(用化学方程式表示)。

④若上述反应在与外界绝热的容器中进行,氨氮比由0.5增加到1.0时,在此过程中该反应的平衡常数___________(填“增大”、“减小”或“不变”)。
【答案】 bd 4NH3(g)+6NO(g)=5N2(g)+6H2O(l) ΔH= ( 3c-3a-2b) kJ·mol-1
[或2CO(g) +2NO(g)=2CO 2 (g)+N2(g) ΔH= ( d-a) kJ·mol-1] 3 增大反应物浓度 NH3 0.09 4NH3+5O2![]() 4NO+6H2O 减小
4NO+6H2O 减小
【解析】(1)氮元素化合价由+2价变成0价,得到电子,被还原,应加还原剂,CO和氨气,答案选bd;已知:N2(g) +O2(g)=2NO(g) △H = a kJ·mol-1 …①;N2(g)+3H2(g)=2NH3(g) △H = b kJ·mol-1…②;2H2(g)+O2(g)=2H2O(l) △H = c kJ·mol-1…③;根据盖斯定律可知3×③-3×①-2×②即得到反应4NH3(g)+6NO(g)=5N2(g)+6H2O(l)的△H=(3c-3a-2b)kJmol-1;(2)①4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g),反应中氨气失电子做还原剂,一氧化氮和氧气得到电子做氧化剂,反应中生成4mol氮气电子转移总数为12mol,若反应生成1molN2,则反应中转移的电子数为3mol;②反应为气体体积增大的放热反应,增大反应物浓度增大反应速率,平衡正向进行,降低温度平衡正向进行,但反应速率减小,减小压强速率减小.平衡正向进行,所以使上述反应速率增大且平衡向右移动的措施是增大反应物浓度:增大反应物浓度;③氨氮比[n(NH3)/n(NO)]越大,则氨气的物质的量越大,氨气的转化率越小,由图可知,随着氨气的浓度的增大,X的转化率减小,所以X为NH3;在体积为2L的容器中模拟进行上述反应,初始时加入8molNO和3.5molO2,氨氮比为0.5时,氨气物质的量为0.5×8mol=4mol,氨气转化率为50%,则
4N2(g)+6H2O(g),反应中氨气失电子做还原剂,一氧化氮和氧气得到电子做氧化剂,反应中生成4mol氮气电子转移总数为12mol,若反应生成1molN2,则反应中转移的电子数为3mol;②反应为气体体积增大的放热反应,增大反应物浓度增大反应速率,平衡正向进行,降低温度平衡正向进行,但反应速率减小,减小压强速率减小.平衡正向进行,所以使上述反应速率增大且平衡向右移动的措施是增大反应物浓度:增大反应物浓度;③氨氮比[n(NH3)/n(NO)]越大,则氨气的物质的量越大,氨气的转化率越小,由图可知,随着氨气的浓度的增大,X的转化率减小,所以X为NH3;在体积为2L的容器中模拟进行上述反应,初始时加入8molNO和3.5molO2,氨氮比为0.5时,氨气物质的量为0.5×8mol=4mol,氨气转化率为50%,则
4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g)
4N2(g)+6H2O(g)
起始浓度(mol/L) 2 4 1.75 0 0
变化浓度(mol/L) 1 1 0.25 1 1.5
平衡浓度(mol/L) 1 3 1.5 1 1.5
K=1.56×14/(14×34×1.5)=0.09;当n(NH3)/n(NO)>1.0时,氨气与氧气的反应生成NO,所以烟气中NO浓度增大,反应的化学方程式为:4NH3+5O2![]() 4NO+6H2O;④若上述反应在与外界绝热的容器中进行,氨氮比增大,即氨气的浓度增大,平衡正向移动过程中放出热量,温度升高,会导致平衡逆向进行,所以氨氮比由0.5增加到1.0时,脱硝主要反应的平衡常数减小。
4NO+6H2O;④若上述反应在与外界绝热的容器中进行,氨氮比增大,即氨气的浓度增大,平衡正向移动过程中放出热量,温度升高,会导致平衡逆向进行,所以氨氮比由0.5增加到1.0时,脱硝主要反应的平衡常数减小。


科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室利用SO2(g)和Cl2(g)合成硫酰氯的实验装置如下图所示(夹持装置已省略):

己知:①SO2(g)+Cl2(g)![]() SO2Cl2(I) ΔH=-97kJ/mol;
SO2Cl2(I) ΔH=-97kJ/mol;
②硫酰氯常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中易“发烟”;
③100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气
回答下列问题:
(1)装置H的名称是_______________,装置E中活性炭的作用是 _____________。
(2)请指出下列装置中应盛入的试剂:B_____________、F________________。
(3)若采用实验室制法制取Cl2,其发生装置应选择_________装置 (用A、B、C等编号填空〉,其中发生反应的离子方程式为____________________。
(4)为什么硫酰氯在潮湿空气中易“发烟”____________ (结合化学方程式说明)。
(5)为了使通入反应器的SO2和Cl2达到最佳反应比例,可观察_________(填现象)来反映通入气体的速率,利用反应液的滴加快慢对气体通入速率加以控制。
(6)该装置尚存在明显的缺陷,请指出_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种过度金属元素,通常用作合金及不锈钢的添加剂。钼酸钠晶体(Na2MoO42H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠及制备金属钼的主要流程图如图所示:

(1)Na2MoO4·2H2O中钼元素的化合价是_______,结晶得到的钼酸钠晶体时粗产品,要得到纯净的钼酸钠晶体,下一步需要进行的操作是___________(填名称)。
(2)焙烧过程中钼精矿发生的主要反应的化学方程式为MoS2+O2![]() MoO3+SO2(未配平),该反应中氧化产物是__________(填化学式);若反应中生成36.0gMoO3,反应中转移电子的数目为__________。
MoO3+SO2(未配平),该反应中氧化产物是__________(填化学式);若反应中生成36.0gMoO3,反应中转移电子的数目为__________。
(3)尾气中含有SO2需要处理,下列不能用作吸收剂的是_______(填序号)。
a.Ca(OH)2 b.HNO3 c.Na2CO3
(4)加入Na2CO3溶液时发生反应的化学方程式为_________。能提高该反应速率的措施有______(填序号)。
a.将粗产品粉碎 b.降低碳酸钠溶液的浓度 c.适当升高温度
(5)利用铝热反应也可回收金属钼,写出MoO3发生铝热反应的化学方程式___________。
(6)已知钼酸钠溶液中c(MoO42-)=0.40molL-1,c(CO32-)=0.52molL-1,由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-,当BaMoO4开始沉淀时,CO32-的去除率为______。[已知:Ksp(BaCO3)=2.6×10-9,Ksp(BaMoO4)=4.0×10-8,忽略溶液的体积变化]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的干燥甲烷燃烧后得到49.6g CO、CO2和H2O(g)组成的气体混合物,将此气体混合物全部缓缓通过足量的浓硫酸时气体质量减少25.2g,下列说法不正确的是( )
A. 产物中水的质量为25.2g B. 参加反应的甲烷为11.2g
C. 产物中CO的物质的量为0.4mol D. 产物中n(CO)=n(CO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B两种原子,A原子的M层比B原子的M层少3个电子,B原子的L层电子数恰好为A原子L层电子数的2倍。A和B分别是
A. Si和Na B. C和Al C. Cl和O D. B和He
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁带在盐酸中反成,产生H2的速率(v)与时间(t)的关系如下图所示。
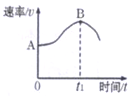
(1)写出该反应的离子方程式____________________。
(2)下列变化:①H+的浓度②镁带的表面积③溶液的温度④Cl-的浓度,不能影响该反应速率的有_________(填写选项的序号)。
(3)0~t1,时间段速率逐渐加快的主要原因是___________。
(4)t1时刻后反应速率变慢的主要原因是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸的适宜条件不包括
A. 矿石粉碎成粉末可加快反应速率 B. 原料气进入接触室之前需净化处理
C. SO2转化为SO3时用铁触媒作催化剂 D. 用98.3%的浓硫酸吸收SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【物质结构与性质】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是____(填元素符号),其中C原子的核外电子排布式为______________;
(2)单质A有两种同素异形体,其中沸点高的是___________(填分子式),原因是_________________;A和B的氢化物所属的晶体类型分为______________和______________;
(3)C和D反应可生成组成比1:3的化合物E,E的立体构型为________________,中心原子的杂化轨道类型___________________;
(4)化合物D2A的立体构型为______________,中心原子的价层电子对数为_______________,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为_____________________;
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为_________,晶胞中A原子的配位数为__________,列式计算晶体F的密度_____________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com