
从某微粒的原子结构示意图反映出( )
A.质子数和中子数 B.中子数和电子数
C.核电荷数和核外电子层排布的电子数 D.质量数和核外电子层排布的电子数
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2008?广东)镁、铜等金属离子是人体内多种酶的辅因子.工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁.
(2008?广东)镁、铜等金属离子是人体内多种酶的辅因子.工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁.| 氧化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b: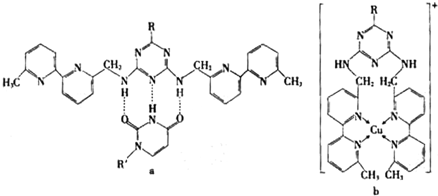
查看答案和解析>>
科目:高中化学 来源: 题型:
镁、铜等金属离子是人体内多种酶的辅因子。工业上从海水中提取
镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁。
(1)以MgCl2为原料用熔融盐电解法制备镁时,常加入NaCl、KCl或CaCl2等金属氯化物,其主要作用除了降低熔点之外还有 。
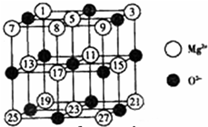
(2)已知MgO的晶体结构属于NaCl型。某同学画出的MgO晶胞结构示意图如下图所示,请改正图中错误: 。
(3)用镁粉、碱金属盐及碱土金属盐等可以做成焰火。燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因: 。
(4)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:![]()
![]()
![]()
![]()
![]()
![]()
![]()
| 氧化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
解释表中氟化物熔点差异的原因: 。
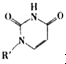
(5)人工模拟是当前研究的热点。有研究表明,化合物X可用于研究模拟酶,当其结合 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b:

①a中连接相邻含N杂环的碳碳键可以旋转,说明该碳碳键具有 键的特性。
②微粒间的相互作用包括化学键和分子间相互作用,比较a和b中微粒间相互作用力的差异 。
查看答案和解析>>
科目:高中化学 来源: 题型:
镁、铜等金属离子是人体内多种酶的辅因子。工业上从海水中提取镁时,先制备无水氯
化镁,然后将其熔融电解,得到金属镁。
(1)以MgCl2为原料用熔融盐电解法制备镁时,常加入NaCl、KCl或CaCl2等金属氯化物,其主要作用除了降低熔点之外还有 。
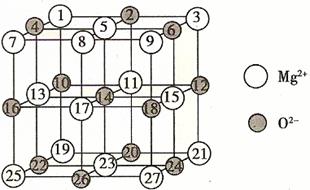
 (2)已知MgO的晶体结构属于NaCl型。某同学画出的MgO晶胞结构示意图如下图所示,请改正图中错误: 。
(2)已知MgO的晶体结构属于NaCl型。某同学画出的MgO晶胞结构示意图如下图所示,请改正图中错误: 。

(3)用镁粉、碱金属盐及碱土金属盐等可以做成焰火。燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因: 。
(4)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:![]()
![]()
![]()
![]()
![]()

![]()
![]()

| 氧化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
解释表中氟化物熔点差异的原因: 。
(5)人工模拟是当前研究的热点。有研究表明,化合物X可用于研究模拟酶,当其结合 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b:

①a中连接相邻含N杂环的碳碳键可以旋转,说明该碳碳键具有 键的特性。
②微粒间的相互作用包括化学键和分子间相互作用,比较a和b中微粒间相互作用力的差异 。
查看答案和解析>>
科目:高中化学 来源: 题型:
镁、铜等金属离子是人体内多种酶的辅因子。工业上从海水中提取
镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁。
(1)以MgCl2为原料用熔融盐电解法制备镁时,常加入NaCl、KCl或CaCl2等金属氯化物,其主要作用除了降低熔点之外还有 。
(2)已知MgO的晶体结构属于NaCl型。某同学画出的MgO晶胞结构示意图如下图所示,请改正图中错误: 。

(3)用镁粉、碱金属盐及碱土金属盐等可以做成焰火。燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因: 。
(4)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:![]()
![]()
![]()
![]()
![]()

![]()
![]()

| 氧化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
解释表中氟化物熔点差异的原因: 。
(5)人工模拟是当前研究的热点。有研究表明,化合物X可用于研究模拟酶,当其结合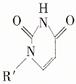 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b:

①a中连接相邻含N杂环的碳碳键可以旋转,说明该碳碳键具有 键的特性。
②微粒间的相互作用包括化学键和分子间相互作用,比较a和b中微粒间相互作用力的差异 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com