
分析 甲烷和氢气的混合气体33.6L(标准状况下),则其物质的量为1.5mol,设甲烷为xmol,氢气为ymol,根据物质的量之比等于热量比,结合热化学方程式计算.
解答 解:甲烷和氢气的混合气体33.6L(标准状况下),则其物质的量为1.5mol,设甲烷为xmol,氢气为ymol,
已知:2H2(g)+O2(g)=2H2O (l)△H=-571.6kJ/mol
2H2(g)+O2(g)=2H2O (g)△H=-483.6kJ/mol
CH4 (g)+2O2(g)=2H2O (l)+CO2(g)△H=-890kJ/mol
常温下,水为液态,则xmol甲烷燃烧放出的热量为890xkJ,ymol氢气燃烧放出热量为$\frac{y}{2}$×571.6kJ,
所以890xkJ+$\frac{y}{2}$×571.6kJ=730.8kJ,
x+y=1.5mol 解得:x=0.5mol,y=1mol,
解得:$\frac{x}{y}$=$\frac{1}{2}$,同温同压下,体积比等于物质的量之比,所以甲烷和氢气体积比为$\frac{1}{2}$,
答:混合气体中甲烷和氢气体积比为$\frac{1}{2}$.
点评 本题考查根据热化学方程式进行的有关反应热的计算,题目难度不大,理解热化学方程式的意义是关键,注意室温下水为液体.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
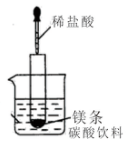 (1)如图所示(夹持仪器省去),把试管放入盛有20℃碳酸饮料的烧杯中,试管中开始放入几块镁条,再用滴管滴加5ml的盐酸于试管中.
(1)如图所示(夹持仪器省去),把试管放入盛有20℃碳酸饮料的烧杯中,试管中开始放入几块镁条,再用滴管滴加5ml的盐酸于试管中.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CO浓度(mol•L-1) | H2浓度(mol•L-1) | 逆反应速率(mol•L-1•min-1) |
| 0.1 | c1 | 9.6 |
| c2 | c1 | 19.2 |
| c2 | 0.3 | 64.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 共价键 | H-H | N≡N | N-H |
| 键能(kJ•mol-1) | 436 | 945 | 391 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
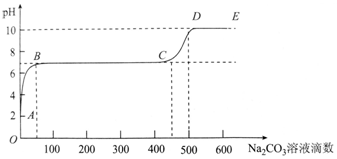
| A. | 开始时溶液pH=2是因为残留液中还有盐酸剩余 | |
| B. | BC段表示随着碳酸钠溶液的滴入,CaCO3沉淀的质量逐渐增加 | |
| C. | 滴入500滴碳酸钠溶液后溶液中c(OH-)>c(H+) | |
| D. | AB发生的反应为:Ca2++CO32-═CaCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.025 mol/L | B. | 0.30mol/L | C. | 0.36mol/L | D. | 0.45mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com