
 B(g)+3C(g)在下列四种状态时属于平衡状态的是( )
B(g)+3C(g)在下列四种状态时属于平衡状态的是( )| A.正反应速率:v(A)=2mol?L-1?s-1 逆反应速率:v(C)=2mol?L-1?s-1 |
| B.正反应速率:v(A)=2mol?L-1?s-1 逆反应速率:v(B)=1.5mol?L-1?s-1 |
| C.正反应速率:v(A)=2mol?L-1?s-1 逆反应速率:v(B)=2mol?L-1?s-1 |
| D.正反应速率:v(A)=1mol?L-1?s-1 逆反应速率:v(C)=1.5mol?L-1?s-1 |


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源:不详 题型:填空题
| A.减小NO2的浓度 | B.降低温度 | C.增加NO2的浓度 | D.升高温度 |
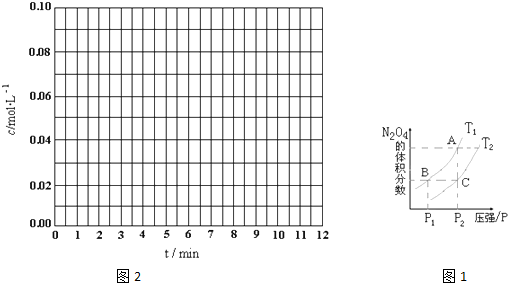
 N2O4(g)的平衡常数K。
N2O4(g)的平衡常数K。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
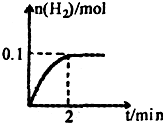
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.各物质的浓度之比为c(A):c(C)=2:3:3 | ||
B.混合气体体积是反应开始前的
| ||
| C.混合气体各物质的浓度相同 | ||
| D.容器内的总压强不随时间的变化而变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 压强\A转化率\温度 | p1(MPa) | p2(MPa) |
| 400℃ | 99.6 | 99.7 |
| 500℃ | 96.9 | 97.8 |
A.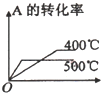 | B.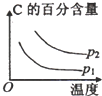 | C.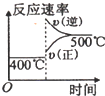 | D. |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
 bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:| a |
| b |
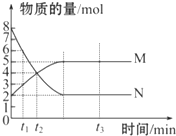
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com