

分析 (1)海水淡化海水就是将海水中的可溶性杂质除去的过程,可根据淡化原理进行分析解答;
(2)根据从海水制备物质的原理可知,金属单质与非金属单质需要利于化学反应来制取,而食盐可利用蒸发原理,淡水利于蒸馏原理来得到;
(3)海水淡化得到母液和电解氯化钠溶液可生成氯气,得到的溴单质浓度低,溴单质在水中有一定的溶解性且和水反应,提取时消耗过的能源和原料,降低了经济效益;
(4)根据反应Br2+SO2+2H2O═4H++SO42-+2Br-有强酸HBr和H2SO4生成,易腐蚀设备;
(5)可以根据反应物和生成物来书写方程式,从反应中找到被还原的氯元素即化合价降低的氯元素,确定钠离子和次氯酸根离子浓度之比等于物质的量之比.
解答 解:(1)淡化海水,应将水与海水中的盐进行分离,常用方法有蒸馏:因水的沸点较低,可用蒸馏法得到蒸馏水,实现海水淡化的目的;电渗析:可使相应的离子通过半透膜以达到硬水软化的效果;以及离子交换法:通过离子交换树脂可以除去海水中的离子,从而达到淡化海水的目的等其它方法,
故答案为:蒸馏法、离子交换法等;
(2)A.可从海水中获得氯化钠,通过电解熔融氯化钠得到钠和氯气,是化学变化,通过氯气将溴离子和碘离子氧化为溴单质和碘单质,是化学变化,故A错误;
B.把海水用蒸馏等方法可以得到淡水,把海水经太阳暴晒,蒸发水分后即得食盐,不需要化学变化就能够从海水中获得,故B正确;
C.可从海水中获得氯化钠,配制成饱和食盐水,然后电解,即得烧碱、氢气和氯气,是化学变化,故C错误;
D.可从海水中获得氯化钠,电解熔融氯化钠得到钠和氯气,是化学变化,通过电解熔融的氯化镁和氧化铝即得镁和铝,是化学变化,故D错误;
故选B;
(3)步骤①中已获得Br2,步骤②中又将Br2还原为Br-,目的是低浓度的Br2溶液在提取时消耗过多的原料和能源,转化为HBr后易被氧化剂氯气氧化为溴单质,用于富集溴元素,
故答案为:富集溴元素;
(4)二氧化硫吸收溴单质,Br元素的化合价由0降低为-1价,Br2在反应中作氧化剂,表现氧化性,S元素的化合价由+4价升高到+6价,SO2作还原剂,发生反应:Br2+SO2+2H2O═4H++SO42-+2Br-,工业生产中应解决的主要问题是反应生成了两种强酸,易腐蚀设备,
故答案为:Br2+SO2+2H2O=4H++SO42-+2Br-;强酸对设备的严重腐蚀;
(5)某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO${\;}_{3}^{-}$的浓度之比为1:3,由Cl到ClO-,失去1个电子,由Cl到ClO3-,失去5个电子,一共失去1+3×5=16个电子;由Cl到Cl-,得到1个电子,需要16个原子才能得到16个电子,反应的化学方程式为:
10Cl2+20NaOH=16NaCl+NaClO+3NaClO3+10H2O,则溶液中c(Na+):c(ClO-)=20:1,
故答案为:20:1.
点评 本题考查了海水资源的综合利用,涉及到海水淡化、海水提溴工艺、萃取等知识点,注意物质的分离、提纯应把握物质的性质的异同,掌握从海水中提取食盐和溴的原理为解答该题的关键,题目难度中等.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:填空题
 △H=-116kJ•mol-1
△H=-116kJ•mol-1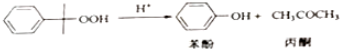 △H=-253k•mol-1
△H=-253k•mol-1
| 物质 | 相对分子质量 | 密度(g/cm-3) | 沸点/℃ |
| 异丙苯 | 120 | 0.8640 | 153 |
| 丙酮 | 58 | 0.7898 | 56.5 |
| 苯酚 | 94 | 1.0722 | 182 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1-戊醇 | B. | 3-戊醇 | ||
| C. | 2,2-二甲基-1-丙醇 | D. | 2-甲基-2-丁醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和甲烷可用溴的四氯化碳溶液鉴别 | |
| B. | 甲烷、苯、乙酸乙酯都可以发生取代反应 | |
| C. | 标况下,1 mol乙醇可与足量的Na反应生成22.4 L H2 | |
| D. | 乙酸可与NaHCO3溶液反应生成CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4溶液能使蛋白质变性 | |
| B. | 糖类、油脂和蛋白质都属于高分子化合物 | |
| C. | 油脂有油和脂肪之分,但都属于酯 | |
| D. | 淀粉、油脂和蛋白质都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①③ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com