
分析 (1)三氯化铁浓溶液滴入沸水中,生成氢氧化铁胶体和盐酸;
(2)二价铁离子有还原性,Cr2O72-有强氧化性,二者能发生氧化还原反应,根据电子得失配平;
(3)充电时阳极失电子发生氧化反应,电极反应式为:2Ni(OH)2+2OH--2e-=Ni2O3+3H2O,所以阳极附近溶液的pH降低,电池放电时,负极反应为Fe+20H-一2e-═Fe(OH)2 ,正极上得电子发生还原反应,电极反应式为Ni2O3+3H2O+2e-=2Ni(OH)2+2OH-;
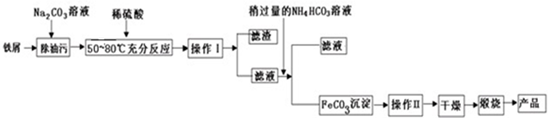
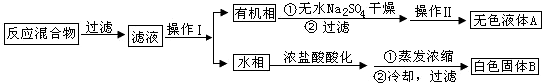
(4)碳酸钠溶液为碱性溶液,能够除去油污,实验步骤①的目的是洗油污,铁屑溶于稀硫酸温度控制在50~800C,加快反应速率、增大FeSO4的溶解度,由工艺流程可知,操作I是将固体与液体分离,应采取过量的方法,加入稍过量的碳酸氢铵,滤液中含Fe2+,与碳酸氢铵反应Fe2++2HCO3-=FeCO3↓+CO2↑+H2O,生成碳酸亚铁沉淀,操作II为洗涤,然后干燥、灼烧得到氧化铁.
①反应温度越高,反应速率越快,FeSO4溶解度随温度升高而增大;
②FeCO3与氧气反应生成三氧化二铁和二氧化碳;
③FeCO3沉淀会附着其它离子,需要进行洗涤,减少杂质,在漏斗中加入适量蒸馏水,浸没过沉淀,让蒸馏水自然流下,重复数次,沉淀未洗净,FeCO3沉淀表面会吸附S042-,用鉴别硫酸根离子的方法判断是否洗净.
解答 解:(1)加热烧杯中的水至沸腾,向沸水滴加几滴饱和氯化铁溶液,继续煮沸至溶液呈红褐色,即停止加热,制得氢氧化铁胶体,反应为:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl,
故答案为:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl;
(2)二价铁离子有还原性,Cr2O72-有强氧化性,二者能发生氧化还原反应,二价铁离子被氧化成三价铁离子,Cr2O72-被还原为Cr3+,反应方程式为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,
故答案为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O;
(3)铁镍蓄电池放电时Fe作负极,发生氧化反应,失电子生成Fe2+,最终生成Fe(OH)2,负极电极反应为Fe+20H-一2e-═Fe(OH)2,Ni2O3作正极,发生还原反应,最终生成Ni(OH)2,所以正极反应为Ni2O3+3H2O+2e-=2Ni(OH)2+2OH-,则充电时,阳极发生2Ni(OH)2+2OH--2e-=Ni2O3+3H2O,阳极附近的pH降低,
故答案为:降低;Fe-2e-+2OH-=Fe(OH)2;
(4)①反应温度越高,反应速率越快,绝大多数固体溶解度随温度升高而增大,铁屑溶于稀硫酸温度控制在50~800C,可加快反应速率、增大FeSO4的溶解度,
故答案为:加快反应速率、增大FeSO4的溶解度;
②在空气中煅烧FeCO3,FeCO3与氧气反应生成三氧化二铁和二氧化碳,反应为:4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2,
故答案为:4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2;
③FeCO3沉淀会附着其它离子,需要进行洗涤,减少杂质,具体操作为:向漏斗中加蒸馏水至浸没沉淀,使水自然流下,重复操作2至3次,FeCO3沉淀表面会吸附S042-,用鉴别硫酸根离子的方法判断是否洗净:取最后一次洗涤液少许于试管中,先加盐酸酸化,再滴加BaCl2溶液,若无沉淀生成则表明沉淀已洗净,反之表明没有洗净,
故答案为:向漏斗中加蒸馏水至浸没沉淀,使水自然流下,重复操作2至3次;取最后一次洗涤液少许于试管中,先加盐酸酸化,再滴加BaCl2溶液,若无沉淀生成则表明沉淀已洗净,反之表明没有洗净.
点评 本题考查元素化合物性质、化学工艺流程、基本操作与方案设计、常用化学用语等,关键是熟练综合应用相关元素化合物知识,要求学生要有扎实的实验基础知识和灵活应用信息解决问题的能力,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ④⑤ | B. | ②④ | C. | ①② | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 气体的密度发生了变化 | B. | 气体的平均分子量发生了变化 | ||
| C. | 气体的颜色发生了变化 | D. | 体系的温度发生了变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 电子天平 b.
电子天平 b.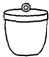 坩埚 c.
坩埚 c.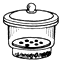 干燥器 d.
干燥器 d.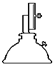 酒精喷灯
酒精喷灯| 加热前质量 | 加热后质量 | |
| m1(容器) | m2(容器+晶体) | m3(容器+无水硫酸铜) |
| 5.200g | 7.900g | 6.900g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
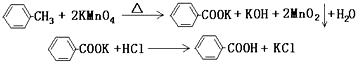
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
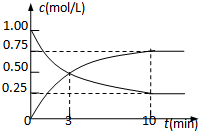 为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.目前,工业上常用CO2来生产燃料甲醇.现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:
为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.目前,工业上常用CO2来生产燃料甲醇.现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 优等品 | 一等品 | 合格品 | |
| 外观 | 白色结晶,无可见机械杂质 | 无可见机械杂质 | |
| 氮(N)含量 | ≥21.0% | ≥21.0% | ≥20.5% |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com