
| A | B | C | D |
 |  |  |  |
| 用Cl2氧化溶液中的Br- | 分离有机层和水层 | 高温结束后先 停止加热后停止通水 | 贮存液溴 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.通入氯气的导管应该插入溶液中;
B.苯的密度小于水,应该在混合液上层;
C.根据温度计水银球位置及冷凝管通水方向判断;
D.液溴具有强氧化性,不能用橡皮塞的试剂瓶盛放.
解答 解:A.用Cl2氧化溶液中的Br-,图示装置中导管没有插入溶液,无法达到实验目的,故A错误;
B.含溴的苯溶液的密度比水小,混合液分层后会在上层,图示有机层位置不合理,故B错误;
C.蒸馏装置中,温度计水银球放在蒸馏烧瓶的支管口处,冷凝管采用逆向通水,图示操作合理,故C正确;
D.液溴能够氧化橡皮塞,应该用玻璃塞的试剂瓶盛放液溴,故D错误;
故选C.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及分液、蒸馏、试剂保存等知识,明确化学实验基本操作方法即可解答,试题培养了学生的分析能力及化学实验能力.


 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:选择题
| A. | 由mXa-与nYb-得,m+b=n+a | |
| B. | X2-的还原性一定大于Y- | |
| C. | X、Y一定是同周期元素 | |
| D. | 若X的原子半径大于Y,则X的氢化物稳定性一定大于Y的氢化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B. | C. | D. |
 |  |  |  |
| 用浸泡过KMnO4溶液的纸张保鲜水果 | 食用油中添加 TBHQ(一种酚类物质) | 红酒中添加 一定量的SO2 | 食品包装袋中 放置还原铁粉 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C5H11Br有7 种同分异构体 | |
| B. | 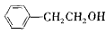 能发生取代、加成、氧化、消去等反应 能发生取代、加成、氧化、消去等反应 | |
| C. | 合成纤维和光导纤维都是新型无机非金属材料 | |
| D. | 溴丙烷水解制丙醇和丙烯与水反应制丙醇的反应类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
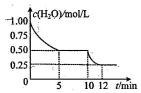 在2L密闭容器中进行反应C(s)+H2O(g)?CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图.下列判断正确是( )
在2L密闭容器中进行反应C(s)+H2O(g)?CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图.下列判断正确是( )| A. | 0~5min内,v(H2)=0.05mol/(L•min) | |
| B. | 5min时该反应的K值一定小于12min时的K值 | |
| C. | 10min时,改变的外界条件可能是减小压强 | |
| D. | 5min时该反应的v(正)大于11min时的v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②⑤ | C. | ①②④⑤ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
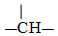 、
、 等结合而成的.试写出同时满足下列条件的烷烃的结构简式:
等结合而成的.试写出同时满足下列条件的烷烃的结构简式: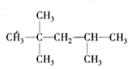
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3g ${\;}_{1}^{3}$H发生核反应:${\;}_{1}^{2}H$+${\;}_{1}^{3}H$→${\;}_{2}^{4}He$+${\;}_{0}^{1}n$,净产生的中子数为NA | |
| B. | 0.1L1mol/L盐酸含有的H+的数目为0.1NA | |
| C. | 标准状况下,22.4LCCl4含有的原子数目为5 NA | |
| D. | 1L0.4mol/L浓盐酸与足量的MnO2反应转移电子的物质的量为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知25℃和101kPa时
(1)已知25℃和101kPa时| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.50 | n1 | 0.34 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.10 | 0.10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com