
分析 (1)室温下取0.1mol•L-1HCl溶液与0.1mol•L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=5,说明得到的盐是强酸弱碱盐,其溶液呈酸性,含有弱根离子水解;
(2)混合液的pH=5,所以水电离出氢离子的浓度为:10-5mol/L,而0.1mol•L-1HCl溶液中由水电离出的H+浓度的$\frac{1{0}^{-14}}{0.1}$mol/L;
(3)根据物料守恒和电荷守恒计算离子浓度大小;
(4)CH3COOM溶液为中性,说明CH3COOH的电离程度与MOH的电离程度相同,而HF常温下电离常数为6.8×10-4,大于1.7×10-5,所以MF是弱酸弱碱盐,但金属阳离子的水解程度大于酸根离子的水解程度,溶液呈酸性,A.MHCO3酸根对应的酸为碳酸,B.CH3COOM的酸根对应的酸为醋酸,C.MClO酸根对应的酸为次氯酸,D.MCl的酸根对应的酸为盐酸,酸性强弱:盐酸>醋酸>碳酸>次氯酸,酸根对应的酸越强水解程度越小,pH越小.
解答 解:(1)等体积等浓度的盐酸和MOH恰好反应生成盐,得到的盐溶液呈酸性,说明该盐是强酸弱碱盐,水解呈碱性,方程式为M++H2O?MOH+H+,
故答案为:M++H2O?MOH+H+;
(2)混合液的pH=5,所以水电离出氢离子的浓度为:10-5mol/L,而0.1mol•L-1HCl溶液中由水电离出的H+浓度的$\frac{1{0}^{-14}}{0.1}$mol/L=10-13mol/L,所以混合溶液中由水电离出的H+浓度是0.1mol•L-1HCl溶液中由水电离出的H+浓度的$\frac{1{0}^{-5}}{1{0}^{-13}}$=108倍,故答案为:108;
(3)根据电荷守恒得c(Cl-)-c(M+)=c(H+)-c(OH-)=10-5 mol/L-10-9 mol/L=(10-5-10-9)mol•L-1,根据质子守恒得 c(H+)-c(MOH)=c(OH-)=1.0×10-9mol•L-1,
故答案为:10-5-10-9;1.0×10-9;
(4)CH3COOM溶液为中性,说明CH3COOH的电离程度与MOH的电离程度相同,而HF常温下电离常数为6.8×10-4,大于1.7×10-5,所以MF是弱酸弱碱盐,但金属阳离子的水解程度大于酸根离子的水解程度,溶液呈酸性,所以MF溶液的pH<7,A.MHCO3酸根对应的酸为碳酸,B.CH3COOM的酸根对应的酸为醋酸,C.MClO酸根对应的酸为次氯酸,D.MCl的酸根对应的酸为盐酸,酸性强弱:盐酸>醋酸>碳酸>次氯酸,酸根对应的酸越强水解程度越小,pH越小,所以pH由小到大的顺序排列:DBAC,
故答案为:<;DBAC.
点评 本题考查酸碱混合的定性判断和计算,为高频考点,侧重于学生的分析能力和计算能力的考查,根据电荷守恒和质子守恒分析弱电解质的电离及盐类水解,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水在结冰时体积膨胀,是由于水分子之间存在氢键 | |
| B. | 由于N、O、F的第一电离能较大,所以NH3、H2O、HF分子间可以形成氢键 | |
| C. | 只要有氢键,物质的熔点和沸点就会升高 | |
| D. | H2O是一种非常稳定的化合物,这是由于氢键所致 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
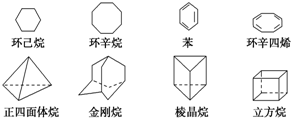 下列是八种环状的烃类物质:
下列是八种环状的烃类物质:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:CO2>KCl>SiO2 | |
| B. | 酸性:HClO4>H2SO4>H3PO4 | |
| C. | 与同浓度的稀盐酸反应剧烈程度:Mg>Al | |
| D. | 热稳定性:HF>H2O>NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石与石墨互为同位素 | |
| B. | 相同物质的量的石墨具有的能量比金刚石具有的能量高 | |
| C. | 金刚石不如石墨稳定 | |
| D. | 等质量的石墨与金刚石完全燃烧,石墨放出的能量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KOH、Ca(OH)2、Mg(OH)2、Al(OH)3的碱性逐渐增强 | |
| B. | Na、Mg、Al、Si的金属性逐渐增强 | |
| C. | O、S、Na、K的原子半径依次增大 | |
| D. | HF、HCl、H2S、PH3的稳定性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①②③⑤ | B. | 只有①④⑤ | C. | 只有①③④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
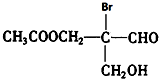 凡有一个手性碳原子的物质具有光学活性,如图物质有光学活性,发生下列反应后生成的有机物仍有光学活性的是( )
凡有一个手性碳原子的物质具有光学活性,如图物质有光学活性,发生下列反应后生成的有机物仍有光学活性的是( )| A. | 与乙酸发生酯化反应 | B. | 与NaOH水溶液共热 | ||
| C. | 与银氨溶液作用发生银镜反应 | D. | 催化剂作用下与H2作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com