
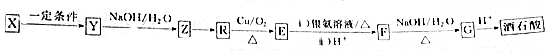
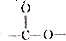 共有6种,其中核磁共振氢谱有3组峰,且锋面积之比为6:1:1的任意一种结构简式为HCOOCH(CH3)2或CH3)2CHCOOH.
共有6种,其中核磁共振氢谱有3组峰,且锋面积之比为6:1:1的任意一种结构简式为HCOOCH(CH3)2或CH3)2CHCOOH.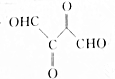 仿照上述题目中工艺图示设计流程为CH2=CHCH=CH2$\stackrel{溴}{→}$CH2BrCHBrCHBrCH2Br$→_{△}^{氢氧化钠溶液}$CH2OHCHOHCHOHCH2OH$→_{铜、△}^{氧气}$
仿照上述题目中工艺图示设计流程为CH2=CHCH=CH2$\stackrel{溴}{→}$CH2BrCHBrCHBrCH2Br$→_{△}^{氢氧化钠溶液}$CH2OHCHOHCHOHCH2OH$→_{铜、△}^{氧气}$ .
. 分析 X在标准状况下密度2.4g•L -1,则X的相对分子质量为约为54,X中氢元素的质量分数为$\frac{1}{9}$,则X中C、H的原子个数比为2:3,所以A的分子式为C4H6,X的核磁共振氢谱有2组峰,且峰面积之比为1:2,X分子不带支链,所以X为CH2=CHCH=CH2,1molY最多能和2molNaOH完全反应,说明Y中有两个羧基,1molZ与足量的钠反应生成1molH2,不与NaHCO3溶液反应,说明Z中有两个羟基,R能发生连续氧化,R的核磁共振氢谱有3组峰,其分子中含有2个溴原子,根据各物质的转化关系及条件可知,X与溴发生1,4加成反应生成Y为BrCH2CH=CHCH2Br,Y在碱性条件下水解得Z为HOCH2CH=CHCH2OH,Z再与溴发生加成得R为HOCH2CHBrCHBrCH2OH,R发生氧化得E为OHCCHBrCHBrCHO,E氧化得F为HOOCCHBrCHBrCOOH,F碱性水解得G为NaOOCCHOHCHOHCOONa,G酸化得酒石酸为HOOCCHOHCHOHCOOH,据此答题.
解答 解:X在标准状况下密度2.4g•L -1,则X的相对分子质量为约为54,X中氢元素的质量分数为$\frac{1}{9}$,则X中C、H的原子个数比为2:3,所以A的分子式为C4H6,X的核磁共振氢谱有2组峰,且峰面积之比为1:2,X分子不带支链,所以X为CH2=CHCH=CH2,1molY最多能和2molNaOH完全反应,说明Y中有两个羧基,1molZ与足量的钠反应生成1molH2,不与NaHCO3溶液反应,说明Z中有两个羟基,R能发生连续氧化,R的核磁共振氢谱有3组峰,其分子中含有2个溴原子,根据各物质的转化关系及条件可知,X与溴发生1,4加成反应生成Y为BrCH2CH=CHCH2Br,Y在碱性条件下水解得Z为HOCH2CH=CHCH2OH,Z再与溴发生加成得R为HOCH2CHBrCHBrCH2OH,R发生氧化得E为OHCCHBrCHBrCHO,E氧化得F为HOOCCHBrCHBrCOOH,F碱性水解得G为NaOOCCHOHCHOHCOONa,G酸化得酒石酸为HOOCCHOHCHOHCOOH,
(1)X为CH2=CHCH=CH2,X的化学名称是1,3-丁二烯,酒石酸的结构简式是 HOOCCHOHCHOHCOOH,
故答案 为:1,3-丁二烯;HOOCCHOHCHOHCOOH;
(2)Z为HOCH2CH=CHCH2OH,Z中官能团的名称是 羟基和碳碳双键,Z生成R的反应类型是加成反应,
故答案为:羟基和碳碳双键;加成反应;
(3)E为OHCCHBrCHBrCHO,E生成F的过程中银氨溶液参与反应的化学方程式是OHCCHBrCHBrCHO+4Ag(NH3)2OH $\stackrel{△}{→}$NH4OOCCHBrCHBrCOONH4+4Ag↓+6NH3+2H2O,
故答案为:OHCCHBrCHBrCHO+4Ag(NH3)2OH $\stackrel{△}{→}$NH4OOCCHBrCHBrCOONH4+4Ag↓+6NH3+2H2O;
(4)F为HOOCCHBrCHBrCOOH,R为HOCH2CHBrCHBrCH2OH,F与R在一定条件下以物质的量之比1:1发生浓缩反应,主要生成高聚物W,W的结构简式为(OCCHBrCHBrCOOCH2CHBrCHBrCH2O)n,
故答案 为:(OCCHBrCHBrCOOCH2CHBrCHBrCH2O)n;
(5)Z为HOCH2CH=CHCH2OH,Z有多种同分异构体,则含有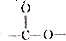 的同分异构体为HCOOCHCH2CH2CH3、HCOOCH(CH3)2、CH3COOCH2CH3、CH3CH2COOCH3、CH3CH2CH2COOH、(CH3)2CHCOOH,共有6种,其中核磁共振氢谱有3组峰,且锋面积之比为6:1:1的任意一种结构简式为HCOOCH(CH3)2或CH3)2CHCOOH,
的同分异构体为HCOOCHCH2CH2CH3、HCOOCH(CH3)2、CH3COOCH2CH3、CH3CH2COOCH3、CH3CH2CH2COOH、(CH3)2CHCOOH,共有6种,其中核磁共振氢谱有3组峰,且锋面积之比为6:1:1的任意一种结构简式为HCOOCH(CH3)2或CH3)2CHCOOH,
故答案为:6;HCOOCH(CH3)2或CH3)2CHCOOH;
(6)X为CH2=CHCH=CH2,以X为原料,经三步制备 ,可以用CH2=CHCH=CH2与溴发生加成生成CH2BrCHBrCHBrCH2Br,CH2BrCHBrCHBrCH2Br碱性水解得CH2OHCHOHCHOHCH2OH,与氧气在铜作催化剂的条件下氧化得
,可以用CH2=CHCH=CH2与溴发生加成生成CH2BrCHBrCHBrCH2Br,CH2BrCHBrCHBrCH2Br碱性水解得CH2OHCHOHCHOHCH2OH,与氧气在铜作催化剂的条件下氧化得 ,流程图为CH2=CHCH=CH2$\stackrel{溴}{→}$CH2BrCHBrCHBrCH2Br$→_{△}^{氢氧化钠溶液}$CH2OHCHOHCHOHCH2OH$→_{铜、△}^{氧气}$
,流程图为CH2=CHCH=CH2$\stackrel{溴}{→}$CH2BrCHBrCHBrCH2Br$→_{△}^{氢氧化钠溶液}$CH2OHCHOHCHOHCH2OH$→_{铜、△}^{氧气}$ ,
,
故答案为:CH2=CHCH=CH2$\stackrel{溴}{→}$CH2BrCHBrCHBrCH2Br$→_{△}^{氢氧化钠溶液}$CH2OHCHOHCHOHCH2OH$→_{铜、△}^{氧气}$ .
.
点评 本题考查有机物的推断与合成,需要学生对给予的反应信息进行应用,给能较好的考查考生的阅读、自学能力和思维能力,是热点题型,掌握官能团的性质是推断关键,注意根据转化关系来源于顺推法进行推断,难度中等.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4溶液能使蛋白质变性 | |
| B. | 葡萄糖能发生氧化反应和水解反应 | |
| C. | 淀粉、油脂、蛋白质都是高分子化合物 | |
| D. | 植物油都不能使溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核外电子数为奇数的基态原子,其原子轨道中一定含有“未成对电子” | |
| B. | 核外电子数为偶数的基态原子,其原子轨道中一定不含“未成对电子” | |
| C. | 核外电子数为偶数的基态原子,其原子轨道中一定含有“电子对” | |
| D. | 核外电子数为奇数的基态原子,其原子轨道中可能含有“电子对” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1的NaCl溶液中含NA个Cl- | |
| B. | 标准状况下,11.2LCCl4中含有0.5NA个分子 | |
| C. | 同温同压下,2NA个C2H4(g)与NA个C4H8(g)的密度不相等 | |
| D. | 64gSO2与足量的O2充分反应后得到NA个SO3分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有SO42- | |
| B. | 一定没有SO42- | |
| C. | 一定有Ag+ | |
| D. | 可能是SO42-,也可能是Ag+,但二者不能同时存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色荧光蛋白分子中氨基酸排列顺序一定相同 | |
| B. | 绿色荧光蛋白能发生颜色反应及盐析、变性等 | |
| C. | 绿色荧光蛋白可发生水解反应生成多种氨基酸 | |
| D. | 绿色荧光蛋白可用于跟踪生物细胞的分子变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com