
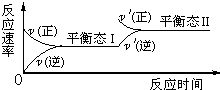
 如图是恒温下某化学反应的反应速率随反应时间变化的示意图,下列叙述与示意图不相符合的是( )
如图是恒温下某化学反应的反应速率随反应时间变化的示意图,下列叙述与示意图不相符合的是( )| A、反应达平衡时,正反应速率和逆反应速率相等 | B、该反应达到平衡态 I后,增大反应物浓度,平衡发生移动,达到平衡态Ⅱ | C、该反应达到平衡态 I后,减小反应物浓度,平衡发生移动,达到平衡态Ⅱ | D、同一种反应物在平衡态 I和平衡态Ⅱ时浓度相等 |


科目:高中化学 来源: 题型:
甲醇合成反应为:CO(g)+2H2(g) ![]() CH3OH(g) 工业上用天然气为原料,分为两阶段制备甲醇:
CH3OH(g) 工业上用天然气为原料,分为两阶段制备甲醇:
(1)制备合成气:CH4+H2O(g)![]() CO+3H2。为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2:CO2+H2=CO+H2O。为了使合成气配比最佳,理论上原料气中甲烷与二氧
CO+3H2。为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2:CO2+H2=CO+H2O。为了使合成气配比最佳,理论上原料气中甲烷与二氧 化碳体积比为__________。
化碳体积比为__________。
(2)合成甲醇:①反应过程中物质能量变化如右图所示。写出合成甲醇的热化学方程式__________________ 。
实验室在1L密闭容器中进行模拟合成实验。将lmolCO和2molH2通人容器中,分别恒温在300℃和500℃反应,每隔一定时间测得容器中甲醇的浓度如下:
 (表中数据单位:mol·L—1)
(表中数据单位:mol·L—1)
②300℃时反应开始10分钟内,H2的平均反应速率为__________。
③500℃时平衡常数K的数值为___________。
④300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系 产生的影响是__________(填字母)。
a.c(H2)减小 b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加 d.重新平衡时c(H2)/c(CH3OH)减小
 (3)甲醇直接燃烧会产生一定的污染,某实验小组依据甲醇燃烧的反应原理,设计如图所示甲醇燃料电池, 该电池负极的电极反应式为 ;工作一段时间后,当9.6g甲醇完全反应时,有 NA个电子转移。
(3)甲醇直接燃烧会产生一定的污染,某实验小组依据甲醇燃烧的反应原理,设计如图所示甲醇燃料电池, 该电池负极的电极反应式为 ;工作一段时间后,当9.6g甲醇完全反应时,有 NA个电子转移。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com