
【题目】五种短周期元素A、B、C、D、E的原子序数依次增大。A和C同族,B和D同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成离子化合物,其阴阳离子个数比为1∶1。回答下列问题:
(1)五种元素中非金属性最强的是_______________(填元素符号)。
(2)由A和B、D、E所形成的共价化合物中,热稳定性最差的是___________(用化学式表示)。
(3)C和E形成的离子化合物的电子式为 ______ ,用电子式表示A和B形成的过程_____,A和E形成的化合物与A和B形成的化合物反应,产物的化学式为_______________
(4)D的最高价氧化物的水化物的化学式为____________________。
(5)由A和B形成的一种气体在工业上用途很广,实验室制取的方程式为____________________。
(6)单质E与水反应的离子方程式为____________________。
【答案】Cl PH3 ![]()
![]() NH4Cl H3PO4 2NH4Cl + Ca(OH)2
NH4Cl H3PO4 2NH4Cl + Ca(OH)2![]() CaCl2 + 2NH3↑+2H2O Cl2+H2O═H++Cl-+HClO
CaCl2 + 2NH3↑+2H2O Cl2+H2O═H++Cl-+HClO
【解析】
五种短周期元素A、B、C、D、E的原子序数依次增大,A和B、D、E均能形成共价型化合物,A和B形成的化合物在水中呈碱性,该化合物为氨气,则A是H元素、B是N元素;A和C同族,且C原子序数大于B,C离子和B离子具有相同的电子层结构,则C是Na元素;B和D同族,则D是P元素;C和E形成离子化合物,其阴阳离子个数比为1∶1,则E是Cl元素,据此分析解答。
根据上述分析,A是H元素,B是N元素,C是Na元素,D是P元素,E是Cl元素。
(1)同一周期元素,元素非金属性随着原子序数增大而增强,同一主族元素,元素非金属性随着原子序数增大而减弱,这几种元素中非金属性最强的是Cl元素,故答案为:Cl;
(2)元素的非金属性越强,其氢化物的稳定性越强,非金属性Cl>N>P,所以氢化物的稳定性最差的是PH3,故答案为:PH3;
(3)C和E形成的化合物是NaCl,属于离子化合物,电子式为![]() ,A和B形成的化合物是氨气,用电子式表示氨气的形成过程为
,A和B形成的化合物是氨气,用电子式表示氨气的形成过程为![]() ,A和E形成的化合物为氯化氢与A和B形成的化合物为氨气,氯化氢和氨气反应生成氯化铵,化学式为NH4Cl,故答案为:
,A和E形成的化合物为氯化氢与A和B形成的化合物为氨气,氯化氢和氨气反应生成氯化铵,化学式为NH4Cl,故答案为:![]() ;
;![]() ;NH4Cl;
;NH4Cl;
(4)D的最高价氧化物的水化物是磷酸,化学式为H3PO4,故答案为:H3PO4;
(5)A和B形成的气体为氨气,在工业上用途很广,实验室制取氨气的方程式为2NH4Cl + Ca(OH)2![]() CaCl2 + 2NH3↑+2H2O,故答案为:2NH4Cl + Ca(OH)2
CaCl2 + 2NH3↑+2H2O,故答案为:2NH4Cl + Ca(OH)2![]() CaCl2 + 2NH3↑+2H2O;
CaCl2 + 2NH3↑+2H2O;
(6)单质E是氯气,氯气和水反应生成HCl和HClO,次氯酸是弱酸,离子方程式为Cl2+H2O═H++Cl-+HClO,故答案为:Cl2+H2O═H++Cl-+HClO。


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:

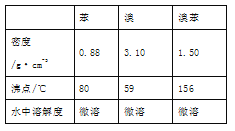
按以下合成步骤回答问题:
(1)在a中加入15 mL苯和少量铁屑。在b中小心加入4.0 mL 液溴。再将b中液溴慢慢加入到a中,充分反应。装置a中发生的主要反应是_____________________________;装置d的作用是________________。
(2)反应过程中,a外壁温度升高,为提高原料利用率,采取以下措施:
①采用装置c进行冷凝回流,回流的主要物质有__________。
②利用温度计控制温度,适宜的温度范围为(填序号)__________。
A.>156℃ B. 59℃-80℃ C.<59℃
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤。
此操作所需要的玻璃仪器除烧杯外,还需___________,用NaOH溶液洗涤的作用是__________;
③向分离出的粗溴苯中加入少量的无水氯化钙,静置、过滤。
(4)经过上述分离操作后,粗溴苯中还含有的主要杂质为__________,要进一步提纯,下列操作中必须的是_________(填入正确选项前的字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中,观察到电流计指针偏转;M棒变粗;N棒变细,由此判断表中所列M、N、P物质,其中可以成立的是
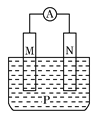
M | N | P | |
A | Zn | Cu | 稀H2SO4溶液 |
B | Cu | Fe | 稀HCl溶液 |
C | Ag | Zn | AgNO3溶液 |
D | Zn | Fe | Fe(NO3)3溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据所学知识,回答下列问题:
某学习小组用如下图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题。
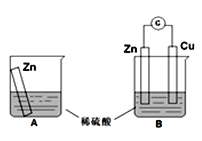
(1)B中Zn板是_________极,发生的电极反应是_________________,Cu板上的现象是___________;
(2)从能量转化的角度来看, A中是将化学能转变为_________,B中主要是将化学能转变为_________;
(3)该小组同学反思原电池的原理,其中观点正确的是_________;
A.原电池反应的过程中一定有电子转移
B.电极一定不能参加反应
C.原电池装置中的电子流向:负极→外线路→正极→电解质→负极
D.氧化反应和还原反应可以拆开在两极发生
(4)在B中,当导线中有1mol电子通过时,理论上的两极变化是_________。
A.锌片溶解32.5g B.锌片增重32.5g
C.铜片上析出2gH2 D.铜片上析出1mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2HI(g)![]() H2(g) +I2(g)的能量变化如图所示。下列说法正确的是
H2(g) +I2(g)的能量变化如图所示。下列说法正确的是
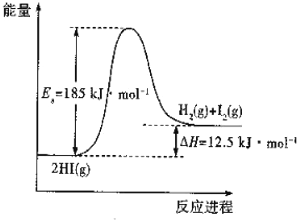
A. 常温下,向体积为VL的容器中充入2mol HI(g)充分反应,可吸收12.5kJ的热量
B. 加入催化剂,分子的能量不变,但单位体积活化分子数增多,速率加快
C. 其他条件不变,升高温度,反应速率加快,HI分解率不变
D. H2(g) +I2(g)![]() 2HI(g)的活化能Ea为12.5kJ·mol1
2HI(g)的活化能Ea为12.5kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的工业加工过程中,可利用CO和H2合成用途广泛的化工原料甲醇,能量变化如图所示。下列说法正确的是
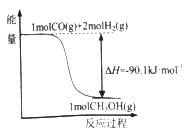
A. 该反应是吸热反应
B. 1molCH3OH所具有的能量为90.lkJ·mol-1
C. CO(g)+2H2(g) ![]() CH3OH(l) △H=-90.1kJ·mol-1
CH3OH(l) △H=-90.1kJ·mol-1
D. 1mol CO和2mol H2断键所需能量小于1mol CH3OH断键所需能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是
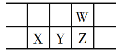
A. 原子半径:W<X
B. 常温常压下,Y单质为固态
C. 气态氢化物热稳定性:Z<W
D. X的最高价氧化物的水化物是强碱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com