
分析 (1)将pH=11的氨水稀释100倍后,稀释后的溶液中氢氧根离子浓度大于原来的$\frac{1}{100}$;
(2)氨水是弱电解质存在电离平衡,向溶液中加入相同的离子能抑制氨水电离;
(3)根据物料守恒和电荷守恒来分析;
(4)①任何水溶液中都有OH-、H+,若溶质只有一种则为NH4Cl,利用铵根离子水解使溶液显酸性来分析;
②C中离子关系可知溶液显酸性,且c(Cl-)>c(H+)>c(NH4+),则溶液为盐酸与氯化铵的混合溶液;
③溶液呈中性,则溶液中氢离子浓度等于氢氧根离子浓度,根据电荷守恒确定溶液中铵根离子浓度和氯离子浓度的关系,氯化铵溶液呈酸性,要使溶液呈中性,氨水应该稍微过量.
解答 解:(1)将pH=11的氨水稀释100倍后,稀释后的溶液中氢氧根离子浓度大于原来的$\frac{1}{100}$,所以溶液的pH应该9-11之间,
故答案为:D;
(2)氯化铵溶于水电离出铵根离子,使氨水中的铵根离子浓度增大平衡向左移动,从而抑制氨水电离,
故答案为:C;
(3)①根据物料守恒知,c(NH4+)+c(NH3•H2O)=0.1mol,
故答案为:NH4+;NH3•H2O;
②根据溶液中电荷守恒得c(Cl-)+c(OH-)=c(H+)+C(NH4+)+C(Na+),c(H+)+c(NH4+)-c(OH-)=c(Cl-)-c(Na+)=0.1mol-0.05mol=0.05mol,
故答案为:NH4+;H+;
(4)①因任何水溶液中都有OH-、H+,若溶质只有一种则为NH4Cl,铵根离子水解方程式为NH4++H2O?NH3.H2O+H+,则c(Cl-)>c(NH4+),水解显酸性,则c(H+)>c(OH-),又水解的程度很弱,则c(Cl-)>c(NH4+)>c(H+)>c(OH-),即A符合,
故答案为:NH4Cl;A;
②C中离子关系可知溶液显酸性,且c(Cl-)>c(H+)>c(NH4+),则溶液为盐酸与氯化铵的混合溶液,其溶质为HCl、NH4Cl,
故答案为:NH4Cl和HCl;
③氯化铵是强酸弱碱盐其水溶液呈酸性,要使氯化铵溶液呈中性,则氨水应稍微过量,因为盐酸和氨水的体积相等,则盐酸的物质的量浓度小于氨水,溶液呈中性,溶液中氢离子浓度等于氢氧根离子浓度,溶液呈电中性,所以溶液中氯离子浓度等于铵根离子浓度,
故答案为:<;=.
点评 本题考查了弱电解质的电离、离子浓度大小的比较等知识点,题目难度中等,根据物质的性质及物料守恒和电荷守恒来分析解答,试题培养了学生的分析能力及灵活应用能力.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:多选题
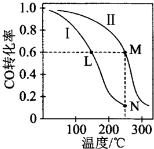
| A. | 该反应的△H>0 | |
| B. | N点化学平衡常数K=0.59 | |
| C. | L、M两点容器内压强:P(M)>2P(L) | |
| D. | 向N点平衡体系中再加入1 mol CH3OH,建立新平衡时被分解的CH3OH物质的量小于0.4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)<c(OH-)的溶液一定显碱性 | B. | pH=6的溶液一定显酸性 | ||
| C. | pH=7的溶液一定显中性 | D. | Kw只适用于纯水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10与12 | B. | 8与17 | C. | 19与17 | D. | 6与14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x个 | B. | $\frac{x}{4}$个 | C. | $\frac{2x}{3}$个 | D. | $\frac{x}{2}$个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水鉴别1-丙醇、甲苯和硝基苯 | |
| B. | 用燃烧法鉴别甲醇、苯和四氯化碳 | |
| C. | 用酸性高锰酸钾溶液鉴别苯和甲苯 | |
| D. | 用溴水鉴别乙苯、苯酚、环己烷和乙醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com