
(实验班)(15分)钡(Ba)和锶(Sr)及其化合物在工业上有着广泛的应用,它们在地壳中常以硫酸盐的形式存在,BaSO4和SrSO4都是难溶性盐。工业上提取钡和锶时首先将BaSO4和SrSO4转化成难溶弱酸盐。
已知:SrSO4(s)  Sr2+(aq)+SO
Sr2+(aq)+SO (aq) Ksp=2.5×10-7
(aq) Ksp=2.5×10-7
SrCO3(s) Sr2+(aq)+CO
Sr2+(aq)+CO (aq) Ksp=2.5×10-9
(aq) Ksp=2.5×10-9
(1)将SrSO4转化成SrCO3的离子方程式为________________________________,该反应的平衡常数为_________ ________(填具体数字);该反应能发生的原因是
_________________________________________(用沉淀溶解平衡的有关理论解释)。
(2)对于上述反应,实验证明增大CO 的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”、“减小”或“不变”):
的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”、“减小”或“不变”):
①升高温度,平衡常数K将________;②增大CO 的浓度,平衡常数K将________。
的浓度,平衡常数K将________。
(3)已知,SrSO4和SrCO3在酸中的溶解性与BaSO4和BaCO3类似,设计实验证明上述过程中SrSO4是否完全转化成SrCO3。实验所用的试剂为________;实验现象及其相应结论为_________________________________________________________。
18. (实验班)
(1)SrSO4(s)+CO32-(aq)  SrCO3(s)+SO
SrCO3(s)+SO (aq) K=
(aq) K= =1×10-2,Ksp(SrCO3)<Ksp(SrSO4),加入CO
=1×10-2,Ksp(SrCO3)<Ksp(SrSO4),加入CO 后,平衡SrSO4(s)
后,平衡SrSO4(s) Sr2+(aq)+SO
Sr2+(aq)+SO (aq)正向移动,生成SrCO3 (2)①减小 ②不变
(aq)正向移动,生成SrCO3 (2)①减小 ②不变
(3)盐酸 若沉淀完全溶解,则证明SrSO4完全转化成SrCO3,否则,未完全转化。
【解析】
试题分析:(1)依据物质Ksp大小可知,SrSO4转化成SrCO3的溶解性不同,反应向更难溶的方向进行,依据沉淀转化写出离子方程式为:SrSO4(s)+CO32-(aq)?SrCO3(s)+SO42-(aq),该反应的平衡常数为K= =1×10-2该反应能发生的原因是Ksp(SrCO3)<Ksp(SrSO4),加入CO
=1×10-2该反应能发生的原因是Ksp(SrCO3)<Ksp(SrSO4),加入CO 后,平衡SrSO4(s)
后,平衡SrSO4(s) Sr2+(aq)+SO
Sr2+(aq)+SO (aq)正向移动,生成SrCO3(2)①实验证明降低温度都有利于提高SrSO4的转化率.说明平衡正向进行,正反应为放热反应,所以升高温度平衡逆向进行,平衡常数K减小;故答案为:减小;②增大CO2-3的浓度平衡正向进行,平衡常数随温度变化,不随浓度改变,所以平衡常数不变;故答案为:不变;(3)SrSO4和SrCO3在酸中的溶解性与BaSO4和BaCO3类似,说明SrCO3溶于酸,SrSO4不溶于酸,证明上述过程中SrSO4是否完全转化成SrCO3.实验所用试剂为盐酸,若沉淀完全溶解,则证明SrSO4完全转化成SrCO3,否则为未完全转化。
(aq)正向移动,生成SrCO3(2)①实验证明降低温度都有利于提高SrSO4的转化率.说明平衡正向进行,正反应为放热反应,所以升高温度平衡逆向进行,平衡常数K减小;故答案为:减小;②增大CO2-3的浓度平衡正向进行,平衡常数随温度变化,不随浓度改变,所以平衡常数不变;故答案为:不变;(3)SrSO4和SrCO3在酸中的溶解性与BaSO4和BaCO3类似,说明SrCO3溶于酸,SrSO4不溶于酸,证明上述过程中SrSO4是否完全转化成SrCO3.实验所用试剂为盐酸,若沉淀完全溶解,则证明SrSO4完全转化成SrCO3,否则为未完全转化。
考点:考查化学平衡常数的含义,难溶电解质的溶解平衡及沉淀转化的本质。


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源:2015届内蒙古赤峰市高三上学期9月质量检测化学试卷(解析版) 题型:填空题
(15分)(物质结构与性质)金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)Ti基态原子的电子排布式为: 。
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。电负性:C (填“>”或“<”,下同)B;第一电离能:N O 。
(3)月球岩石——玄武岩的主要成分为钛硫酸亚铁 与80%的硫酸反应可生成
与80%的硫酸反应可生成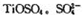 的空间构型为 形,其中硫原子采用 杂化。
的空间构型为 形,其中硫原子采用 杂化。
(4)磷酸肽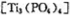 锂离子电池能来那个密度大、安全性高。
锂离子电池能来那个密度大、安全性高。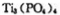 可由
可由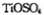 与
与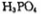 反应制得。两分子
反应制得。两分子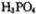 发生脱水生成焦磷酸:
发生脱水生成焦磷酸:
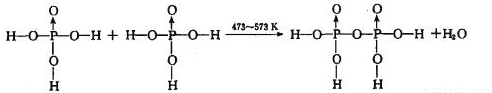
则三分子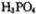 脱去两分子
脱去两分子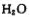 生成三磷酸,其结构式为 ,四分子
生成三磷酸,其结构式为 ,四分子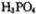 脱去四分子
脱去四分子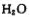 生成的四偏磷酸属于 元酸。
生成的四偏磷酸属于 元酸。
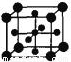
(5)Ti的氧化物和CaO相互作用能形成太酸盐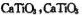 的晶体结构如图所示(Ti位于立方体的顶点)。该晶体中Ti4+和周围 个O2-紧邻。
的晶体结构如图所示(Ti位于立方体的顶点)。该晶体中Ti4+和周围 个O2-紧邻。
(6)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中
实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重
大影响。由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为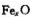 (x<1),若测得某
(x<1),若测得某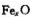 晶体密度为5.71g·cm-3,晶胞边长为4.28×
晶体密度为5.71g·cm-3,晶胞边长为4.28×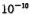 m,则
m,则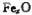 中x= 。
中x= 。
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古巴彦淖尔市高三10月月考化学试卷(解析版) 题型:填空题
(21分)2012年8月24日,武汉市一家有色金属制造厂发生氨气泄露事故。已知在一定温度下,合成氨工业原料气H2制备涉及下面的两个反应:
C(s)+H2O(g) 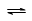 CO(g)+H2(g);
CO(g)+H2(g);
CO(g)+H2O(g)  H2(g)+CO2(g)。
H2(g)+CO2(g)。
(1)判断反应CO(g)+H2O(g) 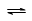 CO2(g)+H2(g)达到化学平衡状态的依据是_____ ___。
CO2(g)+H2(g)达到化学平衡状态的依据是_____ ___。
A.容器内压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(2)在2 L定容密闭容器中通入1 mol N2(g)和3 mol H2(g),发生反应:3H2(g)+N2(g) 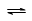 2NH3(g),ΔH<0,测得压强-时间图像如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图像。
2NH3(g),ΔH<0,测得压强-时间图像如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图像。
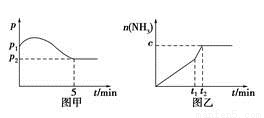
①若图中c=1.6 mol,则改变的条件是________(填字母);
②若图中c<1.6 mol,则改变的条件是_ __(填字母);此时该反应的平衡常数_____(填“增大”、“减小”、“不变”)
A.升温 B.降温 C.加压 D.减压 E.加催化剂
(3)如图甲,平衡时氢气的转化率为________。
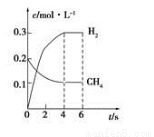
(4)工业上可利用如下反应:H2O (g)+CH4 (g)  CO(g)+3H2(g)制备CO和H2。在一定条件下1 L的密闭容器中充入0.3 mol H2O和0.2 mol CH4,测得H2(g)和CH4(g)的物质的量浓度随时间变化曲线如下图所示:0~4 s内,用H2 (g)表示的反应速率为____________,用CO(g)表示的反应速率为__________。
CO(g)+3H2(g)制备CO和H2。在一定条件下1 L的密闭容器中充入0.3 mol H2O和0.2 mol CH4,测得H2(g)和CH4(g)的物质的量浓度随时间变化曲线如下图所示:0~4 s内,用H2 (g)表示的反应速率为____________,用CO(g)表示的反应速率为__________。
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古巴彦淖尔市高三10月月考化学试卷(解析版) 题型:选择题
下列有关实验现象和解释或结论都正确的是
选项 | 实验操作 | 实验现象 | 解释或结论 |
A | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2 △H<0 |
B | 将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡 | 下层分别呈无色 和紫红色 | 还原性:I- >Br- >Fe2+ |
C | 某钾盐溶于盐酸,产生无色无味气体,通过澄清石灰水 | 有白色沉淀出现 | 该钾盐是K2CO3 |
D | 把SO2通入紫色石蕊试液中 | 紫色褪去 | SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古巴彦淖尔市高三10月月考化学试卷(解析版) 题型:选择题
下列溶液中:①石灰水 ②Na2S溶液 ③KMnO4溶液 ④溴水
⑤酸化的Ba(NO3)2溶液 ⑥品红溶液,不能区别SO2和CO2气体的是
A.②④⑤ B.①② C.①②⑤ D.只有①
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古高二下学期期末考试化学试卷(解析版) 题型:选择题
已知25℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×10-10。现向1 L0.2mol·L-1HF溶液中加入1 L0.2 mol·L-1CaCl2溶液,下列说法中正确的是
A.25℃时,0.1 mol·L-1HF溶液中pH=1
B. Ksp(CaF2)随温度和浓度的变化而变化
C.加入CaCl2溶液后体系中的c(H+)浓度不变
D.该体系中有CaF2沉淀产生
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古高二下学期期末考试化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.反应NH3(g)+HCl(g)= NH4Cl(s)在室温下可自发进行,则该反应的△H<0
B.当镀锡铁和镀锌铁镀层破损时,后者更易被腐蚀
C.CH3COOH溶液加水稀释后,电离平衡正向移动,溶液中的c(CH3COO-)增大
D.Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小
查看答案和解析>>
科目:高中化学 来源:2014~2015江苏省高一上学期期中化学试卷(解析版) 题型:选择题
用下列两种方法制取氯气:
①用含氯化氢146克的浓盐酸与足量的二氧化锰反应
②用87克二氧化锰与足量的浓盐酸反应,
则所得氯气
A.②比①多 B.①比②多 C.一样多 D.无法比较
查看答案和解析>>
科目:高中化学 来源:2014~2015年河北省高一第一学期第一次月考化学试卷(解析版) 题型:选择题
下列反应属于氧化还原反应的是 ( )
A.CaCO3+2HCl===CaCl2+CO2↑+H2O B.CO2+H2O===H2CO3
C.2H2O2催化剂 2H2O+O2↑ D.CaCO3 CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com