
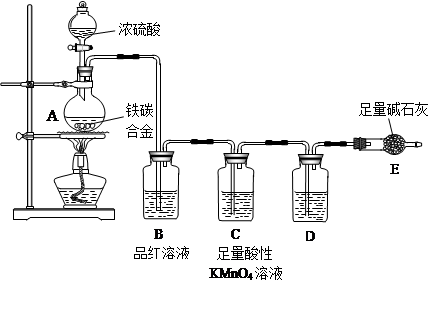
 Fe2(SO4)3+3SO2↑+6H2O(或C+2H2SO4(浓)
Fe2(SO4)3+3SO2↑+6H2O(或C+2H2SO4(浓) CO2↑+2SO2↑+2H2O)(2分); 品红溶液逐渐褪色(2分); 强氧化(2分); 除去CO2中混有的SO2(2分);浓硫酸(2分);
CO2↑+2SO2↑+2H2O)(2分); 品红溶液逐渐褪色(2分); 强氧化(2分); 除去CO2中混有的SO2(2分);浓硫酸(2分); 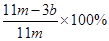 (或
(或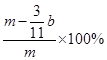 (3分)); 空气中CO2、H2O进入E管使b增大(2分)
(3分)); 空气中CO2、H2O进入E管使b增大(2分) Fe2(SO4)3+3SO2↑+6H2O、C+2H2SO4(浓)
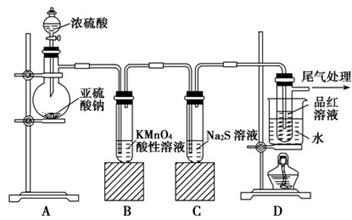
Fe2(SO4)3+3SO2↑+6H2O、C+2H2SO4(浓) CO2↑+2SO2↑+2H2O。SO2具有漂白性,能使品红溶液褪色,所以B中的实验现象是品红溶液逐渐褪色,这说明浓硫酸被还原生成了SO2,因此说明浓硫酸具有强氧化性。由于SO2也是一种酸性氧化物,能干扰CO2的检验,所以酸性高锰酸钾溶液的作用是除去CO2中混有的SO2。由于碱石灰也能吸收水蒸气,所以D装置的作用是干燥CO2气体,所以盛放的试剂是浓硫酸。
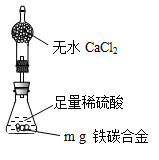
CO2↑+2SO2↑+2H2O。SO2具有漂白性,能使品红溶液褪色,所以B中的实验现象是品红溶液逐渐褪色,这说明浓硫酸被还原生成了SO2,因此说明浓硫酸具有强氧化性。由于SO2也是一种酸性氧化物,能干扰CO2的检验,所以酸性高锰酸钾溶液的作用是除去CO2中混有的SO2。由于碱石灰也能吸收水蒸气,所以D装置的作用是干燥CO2气体,所以盛放的试剂是浓硫酸。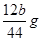 ,则则铁碳合金中铁的质量分数
,则则铁碳合金中铁的质量分数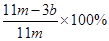 。由于空气中含有水蒸气和CO2,也会加入E装置中,导致b偏大,所以测定结果偏低。
。由于空气中含有水蒸气和CO2,也会加入E装置中,导致b偏大,所以测定结果偏低。

 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源:不详 题型:单选题

| A.该硫酸的物质的量浓度为9.2mol/L |
| B.1molZn与足量的该硫酸反应产生2g氢气 |
| C.配制200mL4.6mol/L的稀硫酸需取该硫酸50 mL |
| D.50mL该硫酸溶液中加入足量的铜片并加热,充分反应后被还原的硫酸的物质的量为0.46mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物 |
| B.SO2是硫酸的酸酐 |
| C.大气中SO2的主要来源是汽车排出的尾气 |
| D.SO2具有漂白性,因而可以使石蕊试液褪色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.吸水性 | B.脱水性 | C.强氧化性 | D.强酸性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
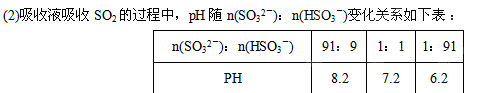
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在未知试液中滴加BaCl2溶液得白色沉淀,取该白色沉淀加稀盐酸不溶解,说明原未知试液中含有SO42- 。 |
| B.在五水硫酸铜中滴加少量浓硫酸,固体颜色由蓝变白,说明浓硫酸具有吸水性 |
| C.在铜片上滴加少量稀硫酸,无明显现象,说明稀硫酸没有氧化性 |
| D.某未知气体通入品红溶液中,品红溶液褪色,则原气体一定是 SO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com