
科目:高中化学 来源: 题型:
(共14分)Ⅰ.化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即用表面皿盖好。(已知2KMnO4+16HCl(浓) 2KCl +2MnCl2 +5Cl2↑+8H2O)?
(1)e处反应的离子方程式为 。
该反应中氧化剂和还原剂的物质的量之比为 。
(2)b处的实验现象: 。?d处的实验现象: 。(3)c处反应的化学方程式为 。
Ⅱ.混合物A由碳酸钠和碳酸氢钠组成。现有两包质量相等的混合物A:
(1)若向其中一包加入100mL 3mol/L的Ba(OH)2溶液(过量),使HCO3-、CO32-全部变为沉淀,过滤后,再向滤液中加入200mL 2mol/L的稀盐酸,溶液恰好呈中性。
①写出下列反应的离子方程式
碳酸氢钠与过量氢氧化钡的反应: ;
②混合物A中NaHCO3的质量为 g。
(2)若向另一包中先加50mL8mol/L的HCl溶液,使HCO3-、CO32-全部变为CO2后,再加50mL2mol/L的Ba(OH)2溶液,混合后的溶液pH=14(混合后溶液体积变化忽略不计、在常温下)。混合物A中Na2CO3的质量为_______________g。
查看答案和解析>>
科目:高中化学 来源:2014届福建省高二下学期期末联考化学试卷(解析版) 题型:填空题
Ⅰ.含氮化合物西瓜膨大剂别名氯吡苯脲,是经过国家批准的植物生长调节剂,实践证明长期使用对人体无害。已知其相关性质如下表所示:
|
分子式 |
结构简式 |
外观 |
熔点 |
溶解性 |
|
C12H10ClN3O |
|
白色结晶粉末 |
170~172℃ |
易溶于水 |
(1)氯吡苯脲的晶体类型为_______ ,所含第二周期元素第一电离能从大到小的顺序为
________________(用元素符号表示)。
(2)氯吡苯脲熔点低,易溶于水的原因分别为 _ 。
(3)查文献可知,可用2-氯-4-氨基吡啶与异氰酸苯酯反应,生成氯吡苯脲。
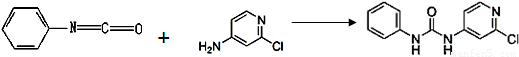
异氰酸苯酯 2-氯-4-氨基吡啶 氯吡苯脲
反应过程中,每生成1mol氯吡苯脲,断裂_______个σ键、断裂_______个π键。
(4)含氮的化合物氨气水溶液逐滴加入硝酸银溶液中制备银氨溶液,写出银氨溶液的配制过程中沉淀溶解的离子方程式 。
Ⅱ.下列是部分金属元素的电离能
|
|
X |
Y |
Z |
|
第一电离能(kJ/mol) |
520.2 |
495.8 |
418.8 |
(5)已知X、Y、Z的价层电子构型为ns1,则三种金属的氯化物(RCl)的熔点由低到高的顺序为:
。
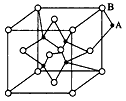
(6)RCl可用作有机合成催化剂, 并用于颜料, 防腐等工业。R+中所有电子正好充满K、L、M 三个电子层,它与Cl-形成的晶体结构如下图所示。元素R基态原子的电子排布式 _ ,
与同一个Cl-相连的 R+有 个。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年安徽省合肥市高三第三次教学质量检测理综化学试卷(解析版) 题型:推断题
X、Y、Z、T、W五种元素的性质或原子结构如下表:
|
元素 |
元素性质或原子结构 |
|
X |
原子的最外层电子数是次外层电子数的2倍 |
|
Y |
常温下单质为双原子分子,其氢化物的水溶液呈碱性 |
|
Z |
基态原子最外层电子排布式为(n+1)sn(n+1)pn+2 |
|
T |
与Z同周期,元素最高价是+7价 |
|
W |
原子序数为Y、T元素之和,不锈钢中含有该元素 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是_______;W元素基态原子电子排布式为________________________。
(2)元素Z与元素T相比,非金属性较强的是_______(用元素符号表示),下列表述中能证明这一事实的是______________。
A.常温下Z的单质和T的单质状态不同
B.T的氢化物比Z的氢化物稳定
C.一定条件下Z和T的单质都能与氢氧化钠溶液反应
D.T的电负性比Z大
(3)常见溶剂XZ2的分子中,含有的 键与π键个数比为_______,它所形成的晶体类型为_______;Y的常见氢化物易液化的主要原因是______________
键与π键个数比为_______,它所形成的晶体类型为_______;Y的常见氢化物易液化的主要原因是______________
(4)①自然界常见的X元素含氧酸的钙盐和适量T的氢化物溶液反应时,每产生4. 4g 气体(不考虑气体溶解)放热a kJ,则该反应的热化学方程式为______________。
②上述反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得PH变化 曲线如下图所示:

请用离子方程式表示BC段、CD段发生的反应:
BC段:__________________________________________;
CD段:__________________________________________。
查看答案和解析>>
科目:高中化学 来源:2015届山东省聊城市高一第四次模块检测化学试卷(解析版) 题型:实验题
(一)括号中的物质是杂质,写出除去这些杂质的试剂:
(1)MgO (Al2O3) (2)Cl2(HCl)
(3)FeCl3(FeCl2) (4)NaHCO3溶液(Na2CO3)
(二)(6分)海水中含有大量的氯化镁,从海水中提取镁的生产流程如下图所示:
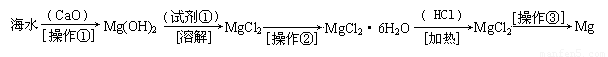
回答下列问题:
写出在海水中加入氧化钙生成氢氧化镁的化学方程式 ;
操作①主要是指 ;试剂①可选用 ;
操作②是指 ;经操作③最终可得金属镁。
(三)(8分)实验室配制480ml 0.1mol·L-1的Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取十水碳酸钠晶体 g。
(2)如图所示的仪器配制溶液肯定不需要的是 (填序号),本实验所需玻璃仪器E规格为 mL。
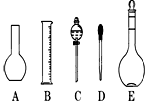
(3)容量瓶上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥酸式或碱式这六项中的 。(填数字符号)
(4)配制所需的主要仪器是:a容量瓶、b烧杯、c胶头滴管、d托盘天平,它们在操作过程中使用的前后顺序是 。(填写字母,每种仪器只能选择一次)
(5)玻璃棒是化学实验中常用的一种玻璃工具,则在配制溶液的过程中玻璃棒共起到了
种用途。(填写数字)
(6)若实验时遇到下列情况,将使溶液的浓度偏低的是 。
A.配制前没有将容量瓶中的水除尽; B.碳酸钠失去了部分结晶水;
C.碳酸钠晶体不纯,其中混有氯化钠; D.称量碳酸钠晶体时所用砝码生锈;
E. 定容时仰视刻度线
查看答案和解析>>
科目:高中化学 来源:2011-2012学年四川省高三九月诊断考试理综试卷(化学部分) 题型:填空题
(共18分) W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。

已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z是是同周期中非金属性最强的元素。
(1)X位于元素周期表的位置 ,X与硫元素形成的化合物的电子式为
(2) Z的气态氢化物和溴化氢相比,较稳定的是 (写化学式)。理由为 。
(3)Y与Z形成的化合物硬度小、熔点低、沸点低,其晶体中有存在的作用力有
其分子属于 (填极性分子、非极性分子),它和足量水反应,有白色胶状沉淀产生,该反应的化学方程式是 。
(4)在25ºC、101 kPa下,已知Y的气态氢化物在氧气中完全燃烧后恢复至原状态,平均每转移1mol 电子放热190.0kJ,该反应的热化学方程是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com